有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有___________________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是_____________、_____________。
(3)B分子中没有支链,其结构简式是__________________________,B的具有相同官能团的同分异构体的结构简式是__________________________。
(4)由B制取A的化学方程式是________________________________________________。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
B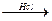 C
C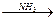 天门冬氨酸
天门冬氨酸
天门冬氨酸的结构简式是________________________。
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl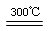 SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
某新型无机非金属材料A,由两种非金属元素组成,其中所含元素的化合价为其最高正价或最低负价,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。A可由化合物B经下列反应制得:①B+NH3→C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解得到A。为探究B的组成,进行了下图所示的转化实验,图中G、F、H均为难溶于水的物质,且为白色粉末,图中字母代表的均为中学化学常见的物质。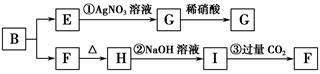
请回答下列问题:
(1)写出化合物B和化合物G的化学式________、________。
(2)A可能所属的晶体类型是________,在A晶体中,每个显正价原子周围结合的另一种原子的个数是________。
(3)写出反应②的离子方程式:_____________________________________________。
(4)写出C经隔绝空气高温分解得到A的化学方程式:_________________________________________________。
(5)分析反应③,你能得出的结论是________(合理即可)。
江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为MgO、Al2O3)工业也较发达。某中学化学探究小组通过查阅相关资料,对蛭石的组成进行了实验探究。
Ⅰ.相关资料:①蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2组成;
②氢氧化物开始沉淀及沉淀完全时的pH:
| 氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
| 沉淀的pH范围 |
1.5~4.1 |
9.4~12.4 |
3.3~5.2 |
Ⅱ.相关实验: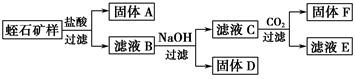
Ⅲ.实验数据:
①矿石样品质量为:8.22 g
②实验过程中得到固体的质量:A—2.40 g、D—2.14 g、F—1.56 g
③每次转化所得固体成分只有一种
请你根据以上内容和中学化学知识回答以下问题:
(1)过滤操作需要的玻璃仪器有:_____________________________________。
(2)写出由D制一种红色颜料的化学方程式:_____________________________________。
(3)工业上的耐火材料通常由F及滤液E进一步转化而成,请你根据滤液E中可能含有的成分,设计一个从滤液E制取耐火材料的实验方法:__________________________。
(4)滤液B与NaOH溶液反应时,应控制溶液的pH在7~8之间,这是因为_______________________________________________________。
(5)通过计算,写出用氧化物的形式表示蛭石组成的化学式:___________________________。
材料是人类生存和社会发展的物质基础,不同的材料功能各不相同。以下都是有关材料的内容,试根据所给内容回答问题。
(1)氢能是未来能源最佳选择之一,氢能的利用涉及氢的储存、输运和使用。贮氢合金是解决氢的储存等问题的重要材料。贮氢合金中最具代表的是镧镍合金(LaNi5),已知LaNi5(s)+3H2(g)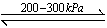 LaNi5H6(s)ΔH=-31.77 kJ·mol-1。
LaNi5H6(s)ΔH=-31.77 kJ·mol-1。
镧镍合金的熔点比镧、镍的熔点________(填“高”“低”或“介于两者之间”),根据反应原理,形成LaNi5H6的化学反应条件是________。最近有人提出可以研制出一种性能优越的催化剂,可以大大提高贮氢合金的贮氢能力,你认为该讲法可信吗?________(填“可信”或“不可信”),其理由是___________________________________________________。
(2)无机非金属材料是日常生活中不可缺少的物质,它往往具有高强度、耐高温、耐腐蚀的特点。Si3N4就是一种重要的精细陶瓷,合成氮化硅的方法之一为:
3SiO2+6C+2N2 Si3N4+6CO。Si3N4属于________晶体,在上述反应中氧化剂为________。
Si3N4+6CO。Si3N4属于________晶体,在上述反应中氧化剂为________。
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被________(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: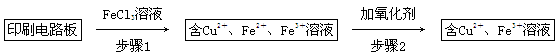
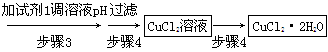
①证明步骤1所加FeCl3溶液过量的方法是_________________________________。
②步骤2中所加的氧化剂最适宜的是______________________________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是________。(写出一种即可)
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) ΔH1=-320 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196 kJ·mol-1
H2(g)+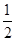 O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的ΔH=________。
(3)欲实现反应Cu+H2SO4=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。