将0.65克Zn粉加入到200ml的足量CuSO4溶液中,锌粉完全溶解,(不考虑反应前后溶液体积的变化)求:
(1)析出铜的物质的量; (2分,写出计算过程)
(2)生成ZnSO4的物质的量及其物质的量浓度; (4分,写出计算过程)
(3)溶液的质量是增加了还是减少了,变化了多少克,说明理由;
按要求填空:
(1)在人类已知的化合物中,种类最多的是第族元素形成的化合物。
(2)用系统命名法命名该物质 。
。
(3)某实验小组欲分离苯和苯酚,向其混合物中加入稍过量的浓氢氧化钠溶液,该反应的化学方程式为。再将反应后的混合物转移到分液漏斗中,振荡、静置,然后分液。从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是;向另一份溶液中加入浓溴水,反应的化学方程式为 。从分液漏斗上口倒出的液体是。
。从分液漏斗上口倒出的液体是。
有机物G广泛用作香精的调香剂,科技人员设计了如下路线合成该物质:
试回答下列问题:
(1)按系统命名法给B物质命名。
(2)D物质的官能团名称。
(3)上述合成路线中属于取代反应的是 (填编号)。
(填编号)。
(4)反应④的化学方程式为。
(5)F有多种同分异构体,其中满足:(ⅰ)属于芳香族化合物;(ⅱ)不能使与FeCl3溶液显色的同分异构体的结构简式为。
下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中常见的金属单质,J是黄绿色气态单质,M与氨水反应生成的O是白色沉淀。在B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。
请按要求回答:
(1)H元素在周期表中的位置。
(2)反应③的离子方程式;
反应④的化学方程式 。
(3)实验室用固体L配制溶液的方法是:
。
(4)由L的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是。若要提纯该胶体,采用的方法叫。
(1)某课外活动小组同学用图 1装置进行实验,试回答下列问题。
1装置进行实验,试回答下列问题。
①若开始时开关K与a连接,则铁发生电化学腐蚀中的腐蚀;
②若开始时开关K与b连接,则总反应的离子方程式。
图1图2
(2)芒硝化学式Na2SO4·10H2O,无色晶体,易溶于水,是一 种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。
种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式为。此时通过阴离子交换膜的离子数(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钠溶液从出口(选填“A”、“B”、“C”、“D”)导出。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有kJ的能量转化为电能。
有甲、乙两个容积均为1 L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) 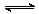 xC(g),①向甲中通入4 mol A、2 mol
xC(g),①向甲中通入4 mol A、2 mol  B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
(1)若乙W%=40%,且建立平衡的过程中乙压强有变化,则x=。
(2)若乙W%=40%,且平衡时甲、乙压强不同,则乙平衡时c(A) =。
(3)若x=4,则W%40% (填“大于”、“小于”或“等于”)。