(原创)铜及其化合物在工农业生产中都有着广泛应用。
(1)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2、Cu2S+O2=2Cu+SO2。当有1molCu生成,则第一个反应中转移电子 mol。
(2)某种处理火法炼铜中SO2废气的工艺流程如下图所示。
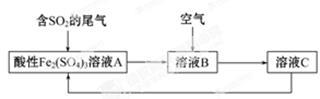
①溶液A中发生的反应为 。
②由流程图可推知Fe3+、O2、SO42-的氧化性由强到弱的顺序为 。
(3)已知反应:3Cu+2NO3-+xH+=3Cu2++2R+yH2O。则
①反应中的x= 。
②反应产物R的化学式为 。
③参加反应的Cu和消耗的HNO3物质的量之比为 。
(1) 请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
FeSO4 +________ → ________ + ________+________+H2O
(2) 反应物中发生氧化反应的物质是________,被还原的元素是________。
(3) 反应中1 mol氧化剂________(填“得到”或“失去”)________mol 电子。
(4) 请将反应物的化学式及配平后的系数填入下列相应的位置中: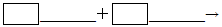
现有m g 某气体,它由四原子分子构成,它的摩尔质量为Mg/mol,则:
(1) 该气体的物质的量为
(2) 该气体所含的原子总数为个
(3) 该气体在标准状况下的体积为
(4) 该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为
(5) 该气体溶于水后形成VL溶液,其溶液的物质的量浓度为
(每空2分,共14分)某河道两旁有甲乙两厂。它们排放的工业废水中,
共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____________。乙厂的废水中含有另外三种离子。
对于该两厂的废水,可采取下列两种方法来处理。
(1)如果在废水中加一定量(选填:活性炭或铁粉),可以发生反应,离子方程式是,并且能够回收其中的金属(填写金属元素符号)。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式: ________________; ____________________。经过滤后的废水主要含,可用来浇灌农田。
已知离子反应: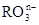 +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在
+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在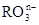 中的化合价是_____。
中的化合价是_____。
某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将
这三种离子逐一沉淀分离。其流程图如下(写出最佳答案):
(1)所加试剂的化学式:A_________、B__________、C__________
(2)写出生成沉淀1的离子方程式_________________________;
生成沉淀3的离子方程式_____________________________