氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2)吸收剂X的化学式为 ;氧化剂Y的化学式为________________。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
| A.H2O | B.稀KOH溶液、异丙醇 | C.NH4Cl溶液、异丙醇 | D.Fe(NO3)3溶液、异丙醇 |
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O CrO42-+Fe(OH)3↓+OH-
CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有 和
和 两种原子,它们互称为,钛基态原子的电子排布式为;
两种原子,它们互称为,钛基态原子的电子排布式为;
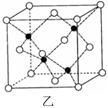
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下:
化合物甲的分子中采取sp2杂化的碳原子个数为,化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为。
(4)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5] 2+中含有的化学键类型是,该配合物的配体是。
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是(填写序号)。
a.蒸馏 b.蒸发浓缩c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
H2CO3 |
H2S |
| Ka/mol·L-1 |
1×10-2 |
6.3×10-4 |
K1=4.30×10-7 K2=5.60×10-11 |
K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为。
(4)Ⅲ装置中生成气体a的电极反应式,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为。
三种短周期元素X、Y、Z,它们的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体。已知X原子的最外层电子数是内层电子数的3倍,X和Y的单质直接化合形成气体A,X和Z的单质直接化合形成液态化合物B,Y和Z的单质直接化合形成的化合物C是一种无色有刺激性气味的气体。
请回答下列问题:
(1)Y元素在周期表中的位置是。
(2)C可在X的单质中燃烧得到Y的单质和化合物B,利用此反应可制成新型的化学电源(KOH溶液做电解质溶液),两个电极均由多孔碳制成,通人的气体由孔隙中逸出,并在电极表面放电,则正极通入的物质是(填物质名称);负极的电极反应式为。
(3)C与X的单质反应生成A的化学方程式为。
(4)常温下,C的水溶液的pH=12,则该溶液中由水电离的C(OH-)= 。若向C溶液中加入等体积、等物质的量浓度的盐酸,所得溶液中水的电离程度(填“大于”、“等于”或“小于”)相同条件下C溶液中水的电离程度。
(5)在2L密闭容器中放入1molC气体,在一定温度进行如下反应:
2C(g)  Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| 总压强P l00 kPa |
4 |
4.6 |
5.4 |
5.8 |
6 |
6 |
该反应的化学平衡常数表达式是(用具体物质的化学式表示);平衡时C的转化率为。
(6)已知:①Y2(g)+2X2(g)=2YX2(g) H=+67.7 kJ·mol-1。
H=+67.7 kJ·mol-1。
②Y2Z4(g)+X2(g)=Y2(g)+2Z2X(g) H="-534" kJ·mol-1。
H="-534" kJ·mol-1。
则2Y2Z4(g)+2YX2(g)=3Y2(g)+4Z2X(g) H=kJ·mol-1
H=kJ·mol-1
H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):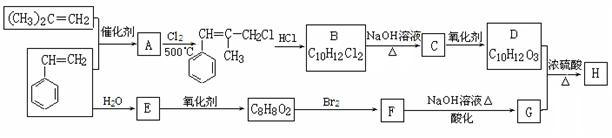
已知:①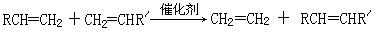
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)用系统命名法命名(CH3)2C=CH2:。
(2)A→B反应过程中涉及的反应类型有。
(3)写出D分子中含有的官能团名称:。
(4)写出生成E的化学方程式:。
(5)写出H的结构简式:。
(6)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有种(不包括立体异构),其中核磁共振氢谱为5组峰的为(写结构简式)。
A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B,G。
(2)写出F的价电子排布图:。
(3)写出化合物BC的结构式:。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是。
(6)E的一种晶体结构如图甲,则其一个晶胞中含有个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)