按要求填写
(1)元素所在的周期序数= ;主族元素所在的族序数= ;
(2)写出最活泼的非金属元素在周期表中的位置___________
(3)指出下列过程中的能量转化形式
①高温分解水 ②甲烷的燃烧
(4)在一定温度下,1molCO气体与1mol水蒸气在催化剂存在下完全反应,生成CO2气体和氢气,放热41kJ的热化学方程式为:
__________________________________________________________________
(1)1mol H2O和1mol H2O2相比较,分子数之比为:
氧原子数之比为:;质量之比为:(最简单整数比)
(2)2mol H2SO4的质量为g,所含氧原子数目为。
选择下列实验方法分离物质,将分离方法的序号填在横线上:
| A.过滤 |
| B.结晶 |
| C.分液 |
| D.蒸馏 |
E.萃取分液
(1)分离水和植物油的混合物;
(2)分离饱和氯化钾溶液和沙子的混合物;
(3)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(5)将碘水中的碘单质与水分离。
下列4组物质均有一种物质的类别与其它三种不同
A.CaO、Na2O、CO2、CuO
B.S、C、P、Cu
C.HCl、H2O、H2SO4、HNO3
以上四组物质中类别不同的物质依次是(填化学式)
A ___;B __;C.
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1;H2CO3的电离常数Ka1=4.2×10-7mol·L-1、 Ka2=5.6×10-11mol·L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因。
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液b、醋酸钠溶液c、氢氧化钠溶液d、氢氧化钡溶液
其PH由大到小的顺序是:(填序号)。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是;该醋酸溶液稀释过程中,下列各量一定变小的是。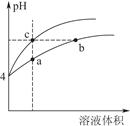
a.c(OH-)b.c(H+)
c.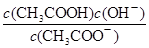 d.
d.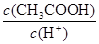
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
氢氧化钠溶液的浓度 (mol·L-1) |
滴定完成时,氢氧化钠溶液滴入的体积(mL) |
待测盐酸的体积(mL) |
| 1 |
0.10 |
24.12 |
20.00 |
| 2 |
0.10 |
23. 88 |
20.00 |
| 3 |
0.10 |
24.00 |
20.00 |
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)△H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)△H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 浓度 浓度 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)=,T1℃时,该反应的平衡常数表达式K=。
②30min后,只改变某一条件,反应重新达到平衡,
根据上表中的数据判断改变的条件可能是(填字母编号)。
a.加入合适的催化剂 b.加入一定量的活性炭
c.通入一定量的NO d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,Q0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是(填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.混合气体的平均相对分子质量不再改变
c.反应体系的压强不再发生改变
d.混合气体的密度不再发生改变