(8分)二甲醚是一种重要的清洁燃料,有多种合成方法。
方法一:通过CH~OH分子间脱水制得:2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H=-23.5 kJ/mol ①
(1)该反应在恒容密闭的容器中进行,能说明反应达到平衡的是_____。(填字母编号)
A.容器中压强不再变化
B.n(CH3OH):nCH3OCH3):n(H2O)="2:1:1"
C.c(CH3OH)=c(CH3OCH3)=c(H2O)
D.混合气体中各组分浓度不再变化
E.混合气体的平均相对分子质量不再变化
(2)在T℃时该反应的平衡常数K=5,若在此温度下某时刻测定出该反应中各物质的浓度为c(CH3OH)="0.3" mol/L、c(CH3OCH3)="0.6" mol/L、c(H2O)=0.6mol/L,则此时正、逆反应速率的大小是V(正)____V(逆)。(填“>”、“<”或“=”
(3)3H2(g)+3CO(g)= CH3OCH3+3CO2(g) ∆H=-a kJ/mol ②
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是_________。(填字母编号)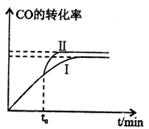
A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚
(4)该反应可以分步进行:
4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H3 ③
CO(g)+H2O(l)=CO2(g)+H2(g) △H4=-bKJ/mol ④
H2O(l)=H2O(g) △H5=+44KJ/mol ⑤
则反应③的焓变△H3=________KJ/mol(用含a、b的代数式表示)
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯. 已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol﹣1
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=32.4kJ•mol﹣1则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H=kJ•mol﹣1
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol﹣1CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ•mol﹣1
2H2S(g)=2H2(g)+S2(g)△H=+169.8kJ•mol﹣1以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为.
(3)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.真空碳热还原﹣氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H="a" kJ•mol﹣13AlCl(g)=3Al(l)+AlCl3(g)△H="b" kJ•mol﹣1反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=kJ•mol﹣1(用含a、b的代数式表示).
(1)下列各种情况,在其中Fe片腐蚀由快到慢的顺序是.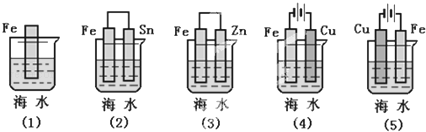
(2)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中负极反应式为;正极反应式为.
完成下列计算
(1) 相同物质的量的O2和O3的质量比____,分子个数比为______,所含氧原子的个数比为_______.
(2) 在200 mL 2 mol/L MgCl2溶液中,溶质的质量为________.此溶液中Mg2+的物质的量浓度为___________,Cl-的物质的量浓度为________.
(3) 在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是________.
(1)某温度下,纯水中的c(H+)=2.0×10—7mol/L,此时溶液的c(OH—)=mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10—4mol/L,则溶液中c(OH—)=mol/L,由水电离产生的c(H+)=mol/L,此时温度25℃(填“高于”、“低于”或“等于”)。
(2)室温时,将pH=5的H2SO4稀释10倍,则c(H+)∶c(SO42—)=,将稀释后的溶液再稀释1000倍,则c(H+)∶ c(SO42—)=。
(3)有稀硫酸和稀盐酸的混合溶液20ml,向此溶液中滴加0.025mol/LBa(OH)2溶液时,生成沉淀的质量和溶液pH的变化情况如图所示,求: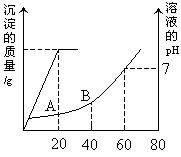
⑴原混合溶液中硫酸和盐酸的物质的量浓度?
⑵滴到A、B两点时溶液的pH 各是多少?
一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是___________________,
②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是_________________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为_____________________,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为_____________________。
⑤当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则开始时反应速率__________________,反应所需的时间___________________。
⑥将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为____________________。