在①Ar ②干冰③SiO2 ④NH4Cl ⑤K2S⑥金刚石六种物质,按下列要求回答(填序号)
⑴只存在共价键的是 ,既存在离子键,又存在共价键的是 ;
⑵熔化时不需破坏化学键的是 ,熔化时需要破坏共价键的是 ;
⑶写出①的电子式是 ,④的电子式是 。
糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖(C6H12O6)。下列说法正确的是________。
A.葡萄糖属于碳水化合物,其分子式可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖为人体提供能量
D.淀粉水解的最终产物是葡萄糖
(2)木糖醇[CH2OH(CHOH)3CH2OH]是一种甜味剂,糖尿病人食用后血糖不会升高。请预测木糖醇的一种化学性质:___________________。
(3)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物A。
A的有关性质实验结果如下:
Ⅰ.通过样品的质谱测得A的相对分子质量为60。
Ⅱ.核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:乙醇(CH3CH2OH)有三种氢原子(图甲)。经测定,有机物A的核磁共振氢谱示意图如图乙所示。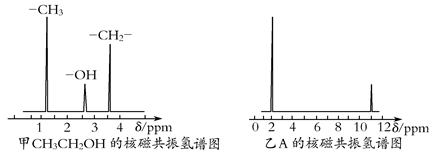
Ⅲ.将A溶于水,滴入石蕊试液,发现溶液变红。
试写出A的结构简式:________________________________。
(4)糖尿病人宜多吃蔬菜和豆类食品。蔬莱中富含纤维素,豆类食品中富含蛋白质。下列说法错误的是________(填序号)。
A.蛋白质都属于天然有机高分子化合物,且都不溶于水
B.用灼烧闻气味的方法可以区别合成纤维和羊毛
C.人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D.紫外线、医用酒精能杀菌消毒,是因为它们能使细菌的蛋白质变性
E.用天然彩棉制成贴身衣物可减少染料对人体的副作用
(5)香蕉属于高糖水果,糖尿病人不宜食用。乙烯是香蕉的催熟剂,它可使溴的四氯化碳溶液褪色,试写出该反应的化学方程式:__________________。
化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。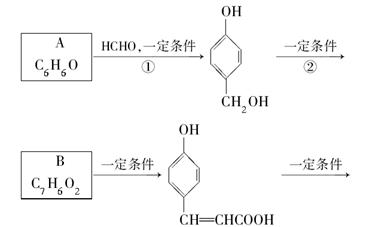
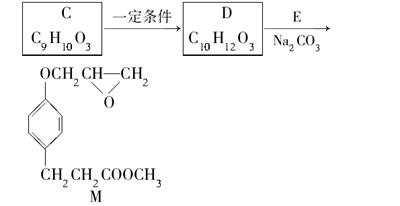
已知:RONa+R′X→ROR′+NaX
根据题意完成下列填空:
(1)写出反应类型。反应①________,反应②________。
(2)写出结构简式 A________,C________。
(3)写出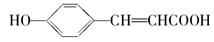 的邻位异构体分子内脱水产物的结构简式________。
的邻位异构体分子内脱水产物的结构简式________。
(4)由C生成D的另一个反应物是________,反应条件是________。
(5)写出由D生成M的化学反应方程式____________________________________。
(6)A也是制备环己醇(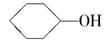 )的原料,写出检验A已完全转化为环己醇的方法________________。
)的原料,写出检验A已完全转化为环己醇的方法________________。
某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为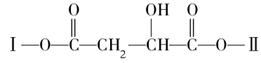
(其中Ⅰ、Ⅱ为未知部分的结构)。为推测X的分子结构,进行如下图的转化: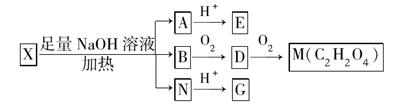
已知向E的水溶液中滴入FeCl3溶液发生显色反应;G、M都能与NaHCO3溶液反应:
(1)M的结构简式是________;G分子所含官能团的名称是________。
(2)E不能发生的反应有(选填序号)________。
| A.加成反应 | B.消去反应 |
| C.氧化反应 | D.取代反应 |
(3)由B转化成D的化学方程式是___________________________。
(4)G在一定条件下发生反应生成分子组成为C4H4O4的有机物(该有机物可使溴的四氯化碳溶液褪色),请写出G发生上述反应的化学方程式____________。
(5)已知在X分子结构中,Ⅰ里含有能与FeCl3溶液发生显色反应的官能团,且E分子中苯环上的一氯代物只有一种,则X的结构简式是________。
(6)F与G互为同分异构体,F的分子中含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。则F的分子结构有________种。
呋喃酚是合成农药的重要中间体,其合成路线如下: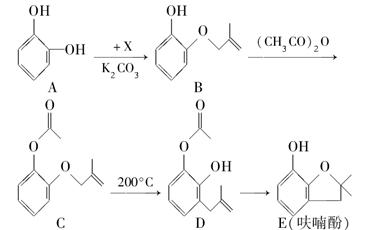
(1)A在空气中久置会由无色转变为棕褐色,其原因是________,A在核磁共振氢谱中有________组峰。
(2)B→C的反应类型是________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:________________。
(4)要鉴别化合物C和D,适宜的试剂是________。
(5)B的同分异构体很多,符合下列条件的有________种,写出其中能发生银镜反应的同分异构体的结构简式:________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
乙酸苯甲酯( )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精。
已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯。其合成路线如下:
据此回答下列问题:
(1)X生成Y的化学方程式为_________________________,生成物Y中含有官能团的名称为_______________________________。
(2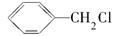 发生反应④所需的条件是____________________,该反应的反应类型为___________________。
发生反应④所需的条件是____________________,该反应的反应类型为___________________。
(3)实验室为鉴别A和B两者的水溶液,可以选用的化学试剂是________。
| A.纯碱溶液 | B.NaOH溶液 | C.金属钠 | D.银氨溶液 |
(4)上述反应①~⑤中原子的理论利用率为100%、符合绿色化学要求的反应是________(填序号)。
(5)请写出反应⑤的化学方程式___________________________________。
(6)写出符合下列条件的乙酸苯甲酯的一种同分异构体:①含苯环结构;②具有酯的结构________。