有机物W-H 有如下的转化关系。已知W、B为芳香族化合物,X为卤素原子,W、A、B均能与NaHCO3溶液反应,A分子中有2个甲基,H分子中含有醛基且苯环上的取代基处于对位。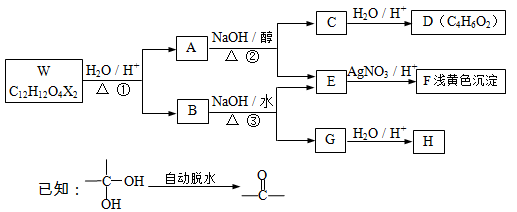
请回答下列有关问题:
(1)反应①、②分别属于 反应、 反应(填有机反应类型),A、B中均含有的含氧官能团的名称是 。
(2)F的化学式 ,B的结构简式 。
(3)若
反应④的化学方程式是 。
(4)反应②的化学方程式是 。
现有某金属的硝酸盐2.160g,充分加热分解生成金属氧化物0.960g和NO2、O2的混合气体0.0270mol(不考虑N2O4).请填空:
(1)混合气体中NO2的物质的量为________mol.
(2)将此组成的混合气体通入足量水中,剩余气体在标准状况下体积为________mL.
(3)该反应中金属元素的化合价________(填升高、降低、不变).
(4)写出该硝酸盐分解的化学方程式,标明电子转移的方向和数目.
同位素示踪法是用同位素作为一种标记,制成含有同位素的标记化合物代替相应的
非标记化合物进行化学反应,然后用核探测器随时追踪它在反应产物中的存在形式来确定反应的原理等。
氧化还原反应氧化剂与还原产物、还原剂与氧化产物之间的内在关系也可以利用同位素失踪法进行验证。
(1)H2O2与H2SO4酸化的KMnO4反应,生成K2SO4、MnSO4、H2O和O2,如果H2O2中氧原子是示踪原子(18O),
反应完成后含有示踪原子的物质是________________。
(2)K35ClO3晶体和含有H37Cl的浓盐酸反应生成氯气,已知反应方程式为KClO3+6HCl(浓)= KCl+3Cl2↑+
3H2O,此反应生成氯气的摩尔质量为________________。
(3)某反应体系中共有6种物质,KClO3、KCl、HCl、Cl2、ClO2、H2O,请你设计同位素失踪法确定反应
的方程式并配平:
将磷肥生产中形成的副产物石膏(
)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除
、
外,还需要等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除
外还含有(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是
溶液。检验滤液中含有
的方法是
(5)已知不同温度下
在100
水中达到饱和时溶解的量如下表:
| 温度(℃) |
0 |
20 |
60 |
|
溶解的量(
) |
7.4 |
11.1 |
18.2 |
60℃时 的饱和溶液591 冷却到0℃,可析出 晶体
(6)氯化钙结晶水合物(
)是目前常用的无机储热材料,选择的依据是
a熔点较低(29℃熔化) b能导电 c能制冷 d无毒
(7)上述工艺流程中体现绿色化学理念的是:。
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下: 
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7
,理论上需
。
(2)实验室进行蒸发浓缩用到的主要仪器有、烧杯、玻璃棒、酒精灯等。
(3)"冷却结晶"过程中,析出
晶体的合适温度为。
(4)不用其它试剂,检查
产品是否纯净的方法及操作是。
(5)若
产品中含有硫酸钠杂质,进一步提纯产品的方法是。
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
| 容器 编号 |
温度 /℃ |
起始量/mol |
平衡量/mol |
达到平衡的时间/min |
达平衡时体系能量的变化/kJ |
||
| CO |
H2O |
CO2 |
H2 |
||||
| ① |
650 |
1 |
2 |
0.4 |
0.4 |
5 |
16.4kJ |
| ② |
650 |
2 |
4 |
t1 |
Q1 kJ |
||
| ③ |
900 |
2 |
4 |
1.6 |
1.6 |
t2 |
Q2 kJ |
(1)计算容器②中反应的平衡常数K=(计算结果保留两位小数)。
(2)容器③中反应达平衡时,CO的转化率为。
(3)容器①中反应达平衡这段时间,化学反应速率v (H2) =。
(4)该反应的正反应为(填“吸热”或“放热”)反应,理由是。
(5)下列叙述正确的是 (填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2 > Q1> 32.8 kJ
c.达到平衡的时间:t2> t1>2.5 min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g)  CO2(g)+H2(g)△H=-41 kJ/mol
CO2(g)+H2(g)△H=-41 kJ/mol
(6)容器②中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,得到的溶液中所有离子的物质的量浓度由大到小的顺序为。