下图中,是单质,是分别和形成的二元化合物。已知:
① 反应能放出大量的热,该反应曾应用于铁轨的焊接;
② 是一种常见的温室气体,它和可以发生反应:++,中元素的质量分数为60%。

回答问题:
(1)①中反应的化学方程式为 ;
;
(2)化合物的电子式为
(3)1.6溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出粒子方程式和计算过程);
(4)与过量溶液反应的粒子方程式为
(5)在中燃烧观察到的现象是
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为________反应(填“吸热”“放热”).
(2)能判断该反应是否已达化学平衡状态的依据是________.
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)某温度下,在2 L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO平衡浓度为0.25 mol/L,试判断此时的温度为________℃.
(4)若在(3)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,H2的物质的量为________.
a.等于1.0 mol b.大于1.0 mol
c.大于0.5 mold.无法确定
塑料电镀是近几十年来发展起来的表面处理新技术,广泛用于电子、家用电器、汽车、建筑等工业。它先是在塑料、陶瓷等非金属表面采用化学沉积的方法沉积出一层金属层,再用电解的方法镀上铜层,电解液为 CuSO4水溶液。
(1)请写出电解时,阴极上可能发生的反应:
① ;
② 。
(2)设通过0.01mol电子后,阴极上沉积出铜 0.2879g , 阴极上还可能放出的气体是。计算标准状况下阴阳极共放出气体的体积。
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:
3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系式_________。
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体。
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)  2SO3(g) (△H< 0)
2SO3(g) (△H< 0)
(1)降低温度,二氧化硫转化率_________,化学反应速率_ (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_______ 。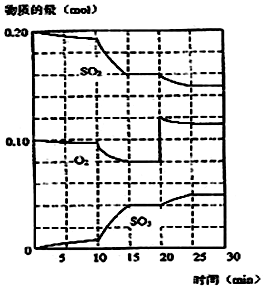
(3)据图判断,反应进行至20min时,曲线发生变化的原因_____ (用文字表达)
(4)10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
A、B、C、D分别是HCl、BaCl2、AgNO3、Na2CO3 四种溶液中的一种,现将它们两两混合,现象如下表所示:
| 反应物 |
A+B |
C+D |
A+D |
A+C |
B+D |
| 现象 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
无色气体 |
由上述现象可推知A、B、C、D的化学式为:A________________ B________________ C________________ D________________