反应 ()在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
()在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
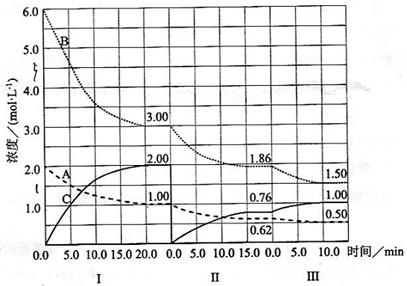
回答问题:
(1)反应的化学方程式中,为
(2)的平均反应速率、、从大到小排列次序为
(3)的平衡转化率中最小的是
(4)由第一次平衡到第二次平衡,平衡移动的方向是
(5)比较第II阶段反应温度()和第III阶段反应速度()的高低:
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出、、).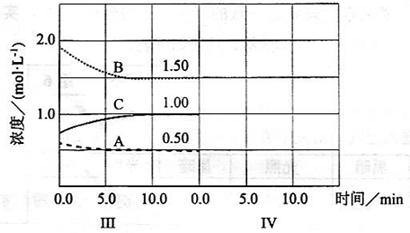
有pH=4的盐酸、硫酸、醋酸三瓶溶液:(以下用>、<、=表示)
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为v1、v2、v3,则其关系是;反应过程中放出H2的速率依次为va、vb、vc,则其关系是。
下列物质中,属于强电解质的是(填序号,下同);属于弱电解质的是;属于非电解质的是。
①氨气;②氨水;③盐酸;④醋酸(CH3COOH);⑤硫酸钡;⑥氯化银;⑦氯化钠溶液;⑧二氧化碳;⑨醋酸铵;⑩氢气
已知可逆反应:A(g)+B(g)  C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)=1 mol/L,c(B)=2.4 mol/L,达到平衡时,A的转化率为60%,此时B的转化率为。
(2)若反应温度降低,则B的转化率将(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)=4 mol·L-1,c(B)=a mol·L-1,达到平衡后c(C)=2 mol·L-1,则a=。
(4)若反应温度不变,反应物的起始浓度分别为c(A)=c(B)=b mol/L,达到平衡后c(D)=。(保留两位有效数字)
甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g)  CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: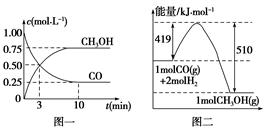
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=,CO的转化率为。
(2)该反应的平衡常数表达式为,温度升高,平衡常数(填“增大”、“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向(填“正”、“逆”)反应方向移动,理由是。
活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和
活性炭(无杂质),生成气体E和F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
| 物质 n/mol T/℃ |
活性炭 |
NO |
E |
F |
| 初始 |
2.030 |
0.100 |
0 |
0 |
| T1 |
2.000 |
0.040 |
0.030 |
0.030 |
| T2 |
2.005 |
0.050 |
0.025 |
0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式:。
(2)上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。
①计算K1=。
②根据上述信息判断,T1和T2的关系是(填序号)。
a.T1>T2 b.T1<T2 c.无法比较
(3)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是(填序号)。
a.增大c(NO)b.增大压强
c.升高温度 d.移去部分F