氧化还原反应在生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1) 3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为
。
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 .
现有如下两个反应:
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
根据两反应本质,判断能否设计成原电池:A、_________,B、__________(选择“能”或“不能”);
(2)如果不能,说明其原因________________________________________________________;
(3)如果可以,则写出正、负极材料及其电极反应式,电解质溶液:
负极材料________,电极反应式_______________,电解质溶液____________;
正极材料________,电极反应式_______________。
(10分)向淀粉溶液和碘水的蓝色混合溶液中通氯气,溶液褪为无色,该反应体系有反应物和生成物共五种物质:I2、HIO3、H2O、Cl2、HCl。
(碘单质遇淀粉变蓝)
(1)该反应中发生氧化反应的物质是__________,氧化剂是___________,
(2)写出该反应的化学方程式,并用双线桥标出电子转移的方向和数目,
(3)如反应转移了0.3 mol电子,则至少需要氯气体积(标准状况下)为_________。
(11分) 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D为单质,E为氯气,试回答: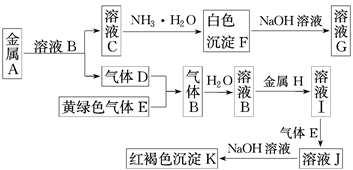
(1)写出下列物质的化学式:A是________,D是________,K是________。
(2)写出反应“C→F”的离子方程式:_____________________________________________。
(3)写出反应“F→G”的化学方程式:_____________________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象及化学方程式:
_________________________________,___________________________________。
(14分)钠、铝、铁是三种重要的金属。请回答:
(1)将一小块金属钠投入水中,发生反应的离子方程式为_____________________;可观察到的实验现象是________(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(2)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。将该产物溶于水配成溶液,分装在三支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成________色。
b.向另一支试管中滴加NaOH溶液,现象为____________________________________,
c.向第三只试管中加入铁粉,反生的离子方程式是______________________________,
d.Fe跟H2O在一定条件下反应的化学方程式__________________________________.
(3)Al既能与盐酸反应又能与氢氧化钠反应,请写出与NaOH溶液反应的化学方程式____________________,若反应过程中有1.2mol电子转移,那么消耗NaOH______________mol
有A、B、C、D四种元素,其原子序数大小关系为A>B>C>D。已知:将0.5molA元素的最高价离子还原成中性原子时,需得到6.02×1023个电子。当A的单质同盐酸充分反应放出0.02g氢气时,用去0.4gA单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢元素生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:
(1)元素符号:A________,B________,C________,D________。
(2)鉴定某物质中含有B元素的最简单的实验是______________________________。
(3)A、B、C三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是_________
__________________(用化学式表示)。