现有如下两个反应:
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
根据两反应本质,判断能否设计成原电池:A、_________,B、__________(选择“能”或“不能”);
(2)如果不能,说明其原因________________________________________________________;
(3)如果可以,则写出正、负极材料及其电极反应式,电解质溶液:
负极材料________,电极反应式_______________,电解质溶液____________;
正极材料________,电极反应式_______________。
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下: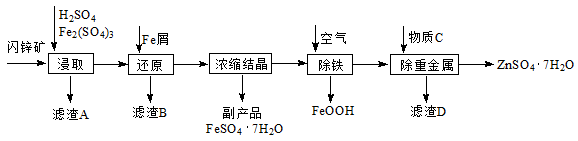
(1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为。
(2)浸取过程中Fe2(SO4)3的作用是。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是。
(4)置换法除重金属离子所用物质C为。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度/g |
41.8 |
54.1 |
70.4 |
74.8 |
67.2 |
60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、、过滤、干燥。
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。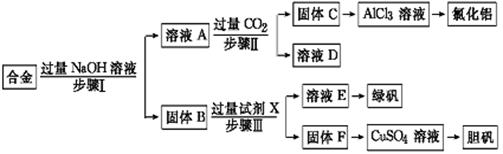
请回答:
(1)写出步骤Ⅰ反应的离子方程式:。
(2)试剂X是。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是。
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是。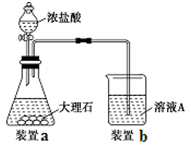
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式,请选出你认为的最佳途径并说明选择的理由。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出此化学反应方程式,并用双线桥标出电子转移的方向和数目:
。
(2)漂白粉的有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,
化学反应方程式为。
通常用小苏打的悬浊液除去CO2中的HCl,反应的离子方程式为:
,不能用NaOH溶液的原因是
,也不能用Na2CO3的原因是
(用离子方程式表示原因)。
在400 mL2 mol·L-1H2SO4溶液中, H+的物质的量浓度为,
SO42-的物质的量浓度为。