工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下: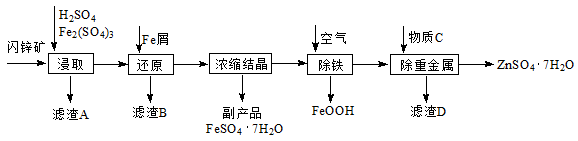
(1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度/g |
41.8 |
54.1 |
70.4 |
74.8 |
67.2 |
60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
A、B、C、D均为中学化学常见物质,且含有一种相同的 元素,它们之间有如下转化关系,其中A是单质。
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式___________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式___________________________________。
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
| A |
|
| C |
(1)D原子结构示意图为_____________。
(2)将C的低价态氧化物甲通入到D单质的水溶液会使之褪色,体现了甲的________性,写出该反应的离子方程式_____________________。
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到100 mL 8.0 mol/L乙的浓溶液中,充分反应,共收集到6.72L(标准状况)气体,则该气体的成分是_________,还原剂失电子数为_________________。
(4)将两份足量的B单质分别加入到等体积等浓度的盐酸和NaOH溶液中,充分反应生成气体的体积比为__________,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_____________________________________;B单质表面的氧化膜可用NaOH溶液除去,写出该反应的化学方程式___________________________________。
化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。
(1)下列有关叙述正确的是__________(填写序号)
a.使用托盘天平的第一步操作是将游码移至标尺零刻度处
b.过滤操作过程中,为加快过滤速度可用玻璃棒对漏斗中的溶液进行搅拌
c.用浓硫酸配制稀溶液时,在量筒中衡稀后要冷却至室温再转移到容量瓶中
d.用容量瓶配制溶液时,定容后摇匀液面下降,再加蒸馏水至刻度线处,所得溶液浓度偏低
(2)现有六种气体:H2、O2、NH3、SO2、NO2、NO。可以利用如图所示装置进行收集。
①若气体从B口进入,可收集的气体是_______________;
②若在烧瓶中注满水,则气体应该从______(填写“A”或“B”)口进入,可以收集的气体是_________________________。
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图,所示(图中球与球之间连线代表化学键单键或双键)。
(1)根据分子结构模型写出A的结构简式 ___________;
(2)拟从芳香烃 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
已知:A在酸性条件下水解生成有机物B和甲醇。
(a)写出⑤反应类型__________;写出H的结构简式 ___________
(b)已知F分子中含有“—CH2OH”,通过F不能有效、顺利地获得B,其原因是 _______
(c)写出反应方程式(注明必要的条件)
⑥ ________________________________________________________
⑦ __________________________________________________________
(3)A的同分异构体有多种,同时满足下列条件A的同分异构体有种:
ⅰ.含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种;
ⅱ.与A有相同的官能团。
Ⅰ.恒温,容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:______________________。
(2)ΔH2=__________kJ·mol-1。
Ⅱ.工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l) CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
(1)该研究小组的实验目的是___________________________________。
(2)60℃下反应40 min与70℃下反应20 min相比,前者的平均反应速率________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40 min、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________________________________(写出两条)。
Ⅲ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
试回答下列问题:
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填“A、B、C、D、E”)。
| n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
0 |
| D |
0.5 |
2 |
1 |
1 |
| E |
3 |
1 |
2 |
1 |
(2)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数为K;
2CO(g)平衡常数为K;
①C(s)+H2O(g) CO(g)+H2(g)平衡常数为K1;
CO(g)+H2(g)平衡常数为K1;
②CO(g)+H2O(g) H2(g)+CO2(g)平衡常数为K2;
H2(g)+CO2(g)平衡常数为K2;
则K、K1、K2之间的关系是______________________________________。