已知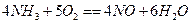 ,若反应速率分别用
,若反应速率分别用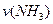 、
、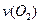 、
、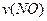 、
、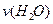 表示,则正确的关系式是:
表示,则正确的关系式是:
A.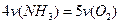 |
B.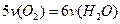 |
C.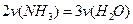 |
D. |
常温时,下列关于电解质溶液的叙述正确的是
| A.稀释pH= 10的氨水,溶液中所有离子的浓度均降低 |
| B.pH均为5的盐酸和氯化铵溶液中,水的电离程度相同 |
| C.等浓度的碳酸钠与碳酸氢钠溶液相比,碳酸钠溶液的pH大 |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
25℃时,浓度均为0.1 moI.L-l的HA溶液和BOH溶液,pH分别是l和11。下列说法正确的是
| A.BOH溶于水,其电离方程式是BOH=B++OH- |
| B.若一定量的上述两溶液混合后pH=7,则c(A—)=c(B+) |
| C.在0.1 mol·L-lBA溶液中,c(B+)>c(A一)> c(OH-)>c(H+) |
| D.若将0.1mol·L-lBOH溶液稀释至0.001mol·L-1,则溶液的pH=9 |
在常温时的下列溶液中,BaSO4的溶解度最大的是
| A.40 mL 1 mol/L的BaCl2溶液 |
| B.30 mL 2 mol/L的Ba(OH)2溶液 |
| C.10 mL纯水 |
| D.50 mL 0.1 mol/L的H2SO4溶液 |
将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
| A.5.52g | B.(m+6.8)g | C.(m+2.55)g | D.(m+12.0)g |
将O2、NO、NH3、HCl分别收集于等体积的四个容器里,用忽略体积的导管把四个容器连成一个整体,若使各种气体充分混和(前后条件均相同,不考虑NO2会转化为N2O4),混和后容器中的压强与原容器中的压强之比为
| A.1:1 | B.1:2 | C.3:4 | D.3:8 |