在一定体积的密闭容器中,进行如下化学反应:

 ,其化学平衡常数K和温度T的关系如下表:
,其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 (填“吸热”或“放热”)反应。
(3)能判断该反应已达到化学平衡状态的依据是( )
| A.容器中压强不变 | B.混合气体中 不变 不变 |
C. |
D. |
(4)某温度下,平衡浓度符合下式: ,试判断此时的温度为 ℃。
,试判断此时的温度为 ℃。
KClO3和浓盐酸在一定温度下反应会生成黄绿色的 易爆物二氧化氯。其变化可表示为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况(用双线桥法表示)
(2)浓盐酸在反应中显示出来的性质是____(填序号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(3)若有1 mol HCl参与反应,则被还原的KClO3为____mol,转移的电子为mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的倍。
写出下列反应的离子方程式
(1)硫酸铜溶液与氢氧化钠溶液混合
(2)碳酸钠溶液与稀盐酸混合
(3)氢氧化钡溶液与稀硫酸混合
(4)少量的碳酸氢钠溶液与过量的澄清石灰反应
(10分)某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液.回答下列问题: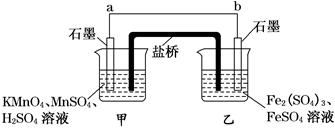
(1)发生氧化反应的烧杯是________(填“甲”或“乙”).
(2)外电路的电流方向为:从________到________.(填“a”或“b”)
(3)电池工作时,盐桥中的SO42-移向________(填“甲”或“乙”)烧杯.
(4)甲烧杯中发生的电极反应为______________________________________________.
(1)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-、HB- H++B2-回答下列问题:在0。1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
H++B2-回答下列问题:在0。1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=2c(Na+)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(2)下表为几种酸的电离平衡常数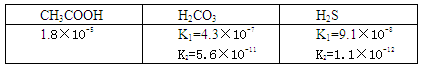
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序,少量CO2与NaHS反应的离子方程式为。
已知下列两个热化学方程式:
H2(g)+  O2(g)====H2O(l) ΔH="-285" kJ·mol-1
O2(g)====H2O(l) ΔH="-285" kJ·mol-1
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l) ΔH="-2" 220.0 kJ·mol-1
(1)实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6264.5 kJ,则混合气体中H2和C3H8的体积比是__________。
(2)已知H2O(l)====H2O(g) ΔH=+44.0 kJ·mol-1
写出丙烷燃烧生成CO2和气态水的热化学方程式____________________________________________。