现有室温下浓度均为1×10-3mol/L的几种溶液①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
(1)PH均等于3的溶液①、②、③、④中水电离产生的c(H+)的比值是
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③ ⑥(填“>”、“<”或“=”),溶液中的离子浓度由大到小的顺序为
(3) 将等体积的①、⑤混合,则溶液的PH 7(填“>”、“<”或“=”),用离子方程式说明其原因
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为 ,最终产生H2总量的关系为
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的PH大小关系为① ③(填“>”、“<”或“=”)
(6)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的PH⑤ ⑥(填“>”、“<”或“=”)
为了研究外界条件对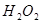 分解反应速率的影响,某同学在四支试管中分别加入
分解反应速率的影响,某同学在四支试管中分别加入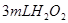 溶液,并测量收集
溶液,并测量收集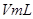 气体所需的时间,实验记录如下:
气体所需的时间,实验记录如下:
| 实验序号 |
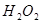 溶液浓度 溶液浓度 |
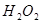 溶液温度 溶液温度 |
催化剂 |
所用时间 |
| ① |
5% |
20℃ |
2滴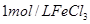 |
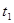 |
| ② |
5% |
40℃ |
2滴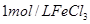 |
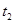 |
| ③ |
10% |
20℃ |
2滴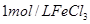 |
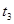 |
| ④ |
5% |
20℃ |
不使用 |
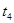 |
请回答:
(1)过氧化氢分解的化学方程式是__________。
(2)实验①②是研究__________对反应速率的影响。
(3)实验测得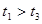 ,原因是__________。
,原因是__________。
(4)实验①④的测定过程如下图,曲线a对应的实验序号是__________(填“①”或“④”)。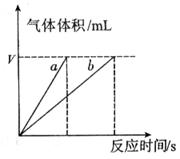
聚合物 的合成路线如下:
的合成路线如下:
(1)在合成 的反应路线中:
的反应路线中:
①生成A的反应类型是。
②由B生成 的化学方程式是。
的化学方程式是。
③聚合物 的结构简式是。
的结构简式是。
(2) 的结构简式是。
的结构简式是。
(3)①D的名称是。
②写出生成 的化学方程式。
的化学方程式。
(4)在合成 的反应路线中:
的反应路线中:
①H的分子式是 ,写出
,写出 的化学方程式。
的化学方程式。
②下列说法正确的是。
a. 乙烯与H互为同系物
b. H的同分异构体中存在芳香烃
c. N分子中可能存在碳碳双键
d. H→N的反应原子利用率是100%
工业上常用天然气作为制备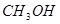 的原料。已知:
的原料。已知:
①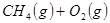
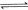
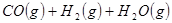
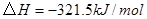
②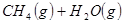
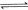
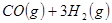
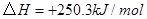
③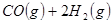
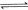
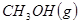
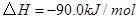
(1)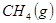 与
与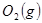 反应生成
反应生成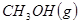 的热化学方程式为。
的热化学方程式为。
(2)向VL恒容密闭容器中充入 与
与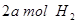 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。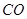 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: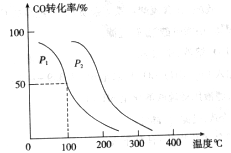
①压强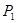
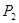 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在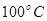 、
、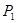 压强时,平衡常数为(用含
压强时,平衡常数为(用含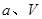 的代数式表示)。
的代数式表示)。
(3)下图是甲醇燃料电池(电解质溶液为稀硫酸)结构示意图,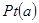 电极通入的
电极通入的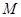 为,电极反应式是。
为,电极反应式是。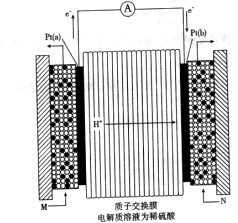
若用该电池电解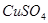 溶液,当得到
溶液,当得到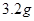 铜时,参加反应的气体
铜时,参加反应的气体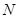 的体积应为
的体积应为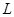 (标准状况)。
(标准状况)。
某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的 。
。
I.取工业硫酸铜固体,用稀硫酸溶解,过滤。
II.向滤液中滴加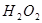 溶液,稍加热。
溶液,稍加热。
III.向II的溶液中加入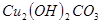 粉末至
粉末至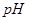 为
为 。
。
IV.加热煮沸,过滤,滤液用稀硫酸酸化至 。
。
V. 加热浓缩、冷却结晶、过滤,得晶体。
已知部分阳离子生成氢氧化物的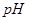 如下表:
如下表:
| 物质 |
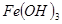 |
 |
 |
开始沉淀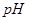 |
2.7 |
7.6 |
4.7 |
完全沉淀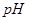 |
3.7 |
9.6 |
6.7 |
(1)II中发生反应的离子方程式是。
(2)II中将 氧化为
氧化为 的目的是。
的目的是。
(3)用 (铁氰化钾)验证II中
(铁氰化钾)验证II中 是否转化完全的现象是。
是否转化完全的现象是。
(4)III中发生反应的离子方程式是。
(5)应用化学平衡移动原理解释IV中“滤液用稀硫酸酸化”的原因。
用 分别滴定
分别滴定 和
和 ,滴定过程中
,滴定过程中 变化曲线如下图所示。
变化曲线如下图所示。
请回答:
(1)滴定盐酸的 变化曲线为(填“图1”或“图2”),判断的理由是
变化曲线为(填“图1”或“图2”),判断的理由是
。
(2)滴定 溶液的过程中,
溶液的过程中,
①当滴加 后,溶液中离子浓度由大到小的顺序为.
后,溶液中离子浓度由大到小的顺序为.
②当 时,溶液
时,溶液 7(填“>”、“=”或“<”)。
7(填“>”、“=”或“<”)。