实验室常用浓硫酸和乙醇混合加
 热制取乙烯。
热制取乙烯。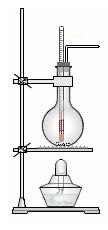
(1) 实验室制乙烯的化学方程式为 。
(2)实验室用浓硫酸和乙醇混合加热制乙烯可用如上图所示装置,下列说法正确的是 。
A.浓硫酸只作催化剂
B.在反应容器中放入几片碎瓷片防止混合液暴沸
C.反应温度缓慢上升至170℃
D.用排水法或向下排气法收集乙烯
E.园底烧瓶中装得是4mL乙醇和12mL3mol/L H2SO4混合液
F.温度计应 插入反应溶液液面下,以便控制温度
插入反应溶液液面下,以便控制温度
G.反应完毕后先熄灭酒精灯,再从水中取出导管
(3)若将此装置中的温度计换成分液漏斗,则还可以制取的气体有(酒精灯 可用可不用) 。
可用可不用) 。
A.CO2 B.NH3 C.O2 D.SO2 E.NO2 F.Cl2
(4) 如温度过高,反应后溶液颜色变 。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。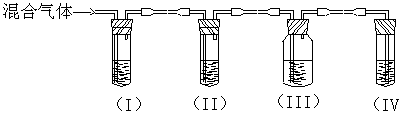
①I、II、III、IV装置可盛放的试剂是(请将下列有关试剂的序号填入空格内):
A、品红 B、NaOH溶液 C、浓硫酸 D、酸性KMnO4溶液
I  ;II ;III ;IV 。
;II ;III ;IV 。
②能说明SO2气体存在的现象是
③使用装置II的目的是 ;
④使用置III的目的是 ;
⑤确定含有乙烯的现象是 。
(6分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______________(写出其中两种物质的化学式)。
(4)ZX的电子式为 。
(1)分别取1mol葡萄糖进行下列实验:
①若使之完全转化为CO2和H2O,所需氧气的体积在标准状况下为_____________L,反应的化学方程式为_____________________________________________________。
②与乙酸反应生成酯,从理论上讲完全酯化需要______g乙酸。
(2)将蔗糖溶于水,配成10%的溶液,分装在两个试管中,在第一支试管中加入新制Cu(OH)2悬浊液后加热没有变化,原因是蔗糖分子中___________;在第二支试管中加入几滴稀H2SO4,再在水浴中加热,加NaOH中和酸后也加入新制Cu(OH)2悬浊液后加热,现象是_________________,原因是____________。
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
| Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______族;
(2)这些元素的氢化物中,水溶液碱性最强的是_____________(写化学式);
(3)XW2的电子式为________________________;
(4)Y的最高价氧化物的化学式为_________________。
21.(12分)已知A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1∶1,气体A相对于H2的密度为21,在下图变化中,中间产物F跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生红色沉淀,H有香味,I为高分子化合物。
已知:
(1)写出下列各步变化的化学方程式(注明反应条件)
反应②_________________________________________________________;
反应⑤_________________________________________________________;
反应⑧_________________________________________________________。
(2)写出下列反应类型:
反应①_____________________,反应②_____________________,
反应⑤_____________________,反应⑧_____________________。
(8分)写出下列反应的化学方程式
(1)乙烯的水化_________________________________________________;
(2)丙烯的加聚反应_____________________________________________;
(3)苯的溴代_________________________________________________;
(4)苯乙烯与足量氢气反应______________________________________。