人们应用原电池原理制作了多种电池,以满足不同的需要。在现代生活、生产和科学技术的发展中,电池发挥着越来越重 要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。
要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。
(1)电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为Ag2O和Zn,电解液为KOH溶液。工作时电池总反应为:Ag2O+Zn+H2O=2Ag+Zn(OH)2。
①工作时电流从 极流向 极(两空均选填“Ag2O”或“Zn”)。
②电极反应式为:正极 ,负极 。
(2)(4分)蓄电池在放电时起原电池作用,在充电时起电解池的作用。爱迪生蓄电池分别在充电和放电时发生的反应 为:
为:
①放电时,正极为 。正极的电极反应式为 。
②该蓄电池中的电解质溶液应为 (选填“酸性”或“碱性”)溶液。
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。
总反应式为:N2+3H2 2NH3
2NH3
则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;
向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3相应的反应方程式为:2N2(g)+6 H2O (g)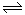 4NH3(g)+3O2(g)△H=Q①
4NH3(g)+3O2(g)△H=Q①
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3), 分别加 入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数 与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。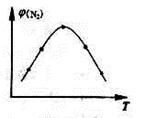
(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(填字母代号),图中△H绝对值为1530kJ·mol-1。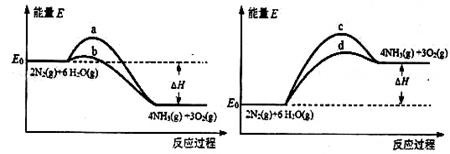
III.目前工业合成氨的原理是: N2(g)+3H2(g)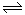 2NH3(g)△H=-93.0kJ/mol②
2NH3(g)△H=-93.0kJ/mol②
回答下列问题:
(1)结合II中的数据,则2H2(g)+ O2(g)="2" H2O (g)的△H=___________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率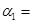 ______________。
______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率
为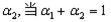 时,则起始时NH3的物质的量
时,则起始时NH3的物质的量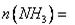 _________mol。
_________mol。
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。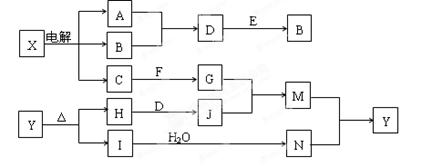
请回答下列问题:(1)B中所含元素位于周期表中第周期族。
(2)A在B中燃烧的现象是。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是。
(4)G + J → M的离子方程式是。
(5)Y受热分解的化学方程式是。
【化学——选修3:物质结构与性质】
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1) COCl2的空间构型为;溴的价电子排布式为。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列式发生。
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是。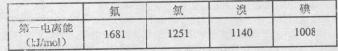
(4)下列分子既不存在s-p 键,也不存在p-p
键,也不存在p-p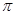 键的是。
键的是。
A. HCl B.HF C.SO2 D.SCl2
(5)已知ClO2一为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为
,写出CN-的等电子体的分子式(写出1个)。
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构如图所示:由此可判断该钙的氧化物的化学式为____。已知该氧化物的密度是 g·cm-3,则晶胞离得最近的两个钙离子间的距离为____cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
g·cm-3,则晶胞离得最近的两个钙离子间的距离为____cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。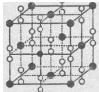
工业上研究燃料脱硫的过程中,涉及如下反应:
CaSO4(s)+CO(g)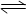 CaO(s)+SO2(g)+CO2(g),K1,△H1=" 218.4" kJ·mol-l(反应I)
CaO(s)+SO2(g)+CO2(g),K1,△H1=" 218.4" kJ·mol-l(反应I) CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g)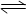
 CaS(s)+2CO2(g),K2,△H2=" -87.8" kJ·mol-l(反应II)
CaS(s)+2CO2(g),K2,△H2=" -87.8" kJ·mol-l(反应II)
(1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H=;平衡常数K=____(用K1,K2表示)。
CaS(s)+3CO2(g)的△H=;平衡常数K=____(用K1,K2表示)。
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
前100 s 内v(SO2)=mo1·L-1·s-l,平衡时CO的转化率为。
(3)若只研究反应II,在不同条件下其反应能量变化如下图所示:图中曲线a到曲线b的措施是________,恒温恒容时,下列说法能说明反应Ⅱ到达平衡状态的是____。
| A.体系中气体的平均摩尔质量不再改变 |
| B.v(CO)=v(CO2) |
| C.CO的转化率达到了最大限度 |
| D.体系内气体压强不再发生变化 |
(4)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量[用n(CO)表示]对CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是
____。
②图像中T2T1(填“高于”、“低于”、“等于”或“无法确定”):判断的
理由是____。
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O 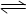 4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有。
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 |
制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____ ________________。
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为____,正极反应为:____。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____mol。