在一定条件下有以下转化关系,已知A、B、C中均含有同种元素。请回答下列问题。
 |
(1)若D为日常生活中最常见的金属单质之一,且以上反应均为氧化还原反应;除以上四种物质外,整个转化过程中没有其它物质参与或生成。
①构成D单质的元素在周期表中的位置是 ;
②反应③的离子方程式 。
③试叙述检验物质B中阳离子的实验方法 。
(2)若无反应③的转化过程,C为红棕色气体,试分析:
①A、B、C中含有的共同元素为(写名称): 。
②C与H2O反应的化学方程式为 。
③若A为化合物时其电子式为 。
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是: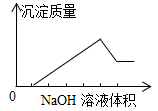
| A.Mg2+、Al3+、Fe2+ |
| B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ |
| D.只有Mg2+、Al3+ |
在里或下能够导电的化合物叫做电解质,电解质溶液之所以能够导电,是由于它们在溶液里发生了,产生了。酸与碱发生中和反应的实质是
在化学反应中,如果反应前后元素化合价发生变化,就一定量有转移,这类反应就属于反应,元素化合价升高,表明该元素的原子电子,含有该元素的物质发生反应,这种物质是剂,元素化合价降低,表明该元素的原子电子,含有该元素的物质发生反应,这种物质是剂。
在0.3 molNH3中约含NH3的分子数是个原子数是个这些NH3中所含的分子数与mol的水分子数相等,与mol的硫酸分子数相等。
(12分)化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)  2CO(g)平衡常数K的表达式为;
2CO(g)平衡常数K的表达式为;
已知C(s) + H2O(g) CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)  CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为。
(2)已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19
2SO3,的平衡常数K=19
在该温度下的体积固定的密闭容器中充入C(SO2)=1mol·L-1,C(O2)="1" mol·L -1,当反应在该温度下SO2转化率为80%时,该反应(填“是”或“否”)达到化学平衡状态,若未达到,向(填“正反应”或“逆反应”) 方向进行。
-1,当反应在该温度下SO2转化率为80%时,该反应(填“是”或“否”)达到化学平衡状态,若未达到,向(填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g) cC(g)+dD(g)△H = a kJ·mol-1;
cC(g)+dD(g)△H = a kJ·mol-1;
若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)