( 16分)下图表示几种无机物之间的转化关系.其中A 、B 均为黑色粉末,B为非金属单质,C 为无色无毒气体,D为金属单质,E 是红棕色气体,G 是具有漂白性的气体,H 的水溶液呈蓝色.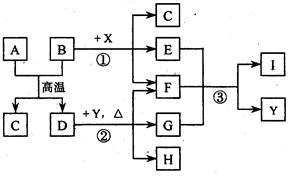
请回答下列问题:
(l)A的化学式是_____________,C 的电子式是_______________,Y 的名称是_______________.
(2)反应① 的化学方程式为______________________________________.
(3)实验室测定气体E 的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)_______________ _____________________.
(4)用石墨作电极电解H 的水溶液,电解总反应的离子方程式是____________ ______.
(5)推测反应③ 的还原产物可能是______________________.
(6)19.2 g的D与足量的一定浓度X的溶液反应,将所得的气体与 LO2(标准状况下)混合,恰好能被水完全吸收.
某有机物A化学式为C3H6O3,1molA能与2molNa反应,A中有两个官能团,两个官能团连在同一个碳原子上。
(1)A的结构简式是 _____________________,官能团名称是____________________
(2)A在浓H2SO4加热的条件下可以生成六元环状物质,写出这反应的化学方程式_____________________反应类型为:_____________________
(3)A在浓H2SO4加热的条件下发生消去反应生成B,B在一定条件下可以合成有机高分子C,写出B生成C的化学方程式________。
Ⅰ.(1)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.60 kJ·mol-1。
2NH3(g) ΔH=-92.60 kJ·mol-1。
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
 时间(h) 时间(h)物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
Ⅱ.(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含极性共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚是非极性分子 D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
(2)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),H+移动方向为:由 到 (填A或B),写出A电极的电极反应式:___________。
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用所给的工艺流程生产单质碘:
(1)碘位于元素周期表中的第_______周期第 族。
(2)步骤③加Fe的目的是__________________
(3)写出步骤④的化学方程式:________________。
(4)上述生产流程中,可以循环利用的副产物是 ,己知上述流程得到的该副产物含杂质,现需将其制成生产所需的试剂,先后还需加入__________、__________来进行处理。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)__________。
(6)第⑤步操作可供提纯I2的两种方法是 和__________。
有X、Z、W三种含14个电子的粒子,其结构特点如下:
| 粒子代码 |
X |
Z |
W |
| 原子核数目 |
单核 |
同元素构成的两核 |
同元素构成的两核 |
| 粒子的电性 |
电中性 |
两个负电荷 |
电中性 |
(1)X的氧化物晶体中含有化学键类型是_____________。
(2)Z与钙离子组成的化合物的电子式为_____________。
(3)组成W的元素的简单氢化物极易溶于水的主要原因是 ,该氢化物与空气可以构成一种燃料电池,产物为无毒物质,电解质溶液是KOH溶液,其负极的电极反应式为____ 。在常温下,用该电池电解1.5 L 1mol/LNaCl溶液,当消耗标准状况下1.12LW的简单氯化物时,NaCl溶液的pH=
(假设电解过程中溶液的体积不变)。
(4)M原子核外比X原子多2个电子。可逆反应2MO2(气)+O2(气) 2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B中分别充入1molO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应。则:达平衡所需时间:t(A)___________t (B)(填“>”、“<”、“=”,或“无法确定”,下同)。平衡时MO2的转化率:a(A)_____________a(B)。
(5)欲比较X和M两元素的非金属性相对强弱,可采取的措施有 (填序号)。
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易
分别在密闭容器的两个反应室中进行如下反应:
左反应室:A(g)+2B(g) 2C(g) 右反应室:2Z(g)
2C(g) 右反应室:2Z(g) X(g)+Y(g)
X(g)+Y(g)
在反应室之间有无摩擦、可自由滑动的密封板隔断。反应开始和达到平衡时有关物理量的变化如下图所示:
(1)A(g)+2B(g) 2C(g) 的△H 0(填“>”、“<”或“=”)。
2C(g) 的△H 0(填“>”、“<”或“=”)。
(2)在平衡(I)和平衡(Ⅱ)中,X的体积分数 (填序号)。
a.一定相等 b.一定不相等 c.可能相等
(3)达到平衡(I)时,A的转化率为 。