X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
| Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
1、X单质分子的结构式是 ,Z元素原子最外层共有_____种不同运动状态的电子。
2、X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是 。
3、常温时,W的硫酸盐溶液的pH 7(填“=”、“>”或“<”),理由是:
(用离子方程式表示)。
4、25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。
对反应3Cl2 + 8NH3== 6 NH4Cl + N 2
(1)该反应中的氧化剂是__________ ,被氧化的元素是。
(2) 1 mol Cl2参加反应,被氧化的NH3的物质的量是mol。
(3) 标出该反应中电子转移情况 。
(4) 若有68g NH3参加反应,电子转移的物质的量是mol。
下列物质中,物质的量最大的是________(填序号,下同),含分子个数最多的是________,含原子个数最多的是________,质量最大的是________。
| A.92 g乙醇(C2H5OH); | B.0.5 mol CO2; | C.148 g H2SO4; |
| D.6 g H2; E.1.204×1024个HCl分子; F.4 ℃时10 mL水 |
100 mL 0.1 mol·L-1 Ba(OH)2溶液与50 mL 0.1 mol·L-1 Na2CO3溶液混合后,边滴边振荡,逐滴加入0.1 mol·L-1 HCl至pH等于7,则需要加入盐酸的体积为_____________mL;如果再加入0.1 mol·L-1酸化的AgNO3溶液至Cl-刚好完全沉淀,则需要加入AgNO3溶液的体积为_____________mL。
用中和滴定的方法测定NaOH和Na2CO3混合溶液中NaOH的含量时,可先在混合溶液中加入过量的氯化钡溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。试完成下列问题:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3溶解而能测定NaOH的含量?_______________________________________________________________________。
(2)滴定终点时溶液颜色如何变化?______________________________________________。
(3)滴定时,若滴定管中滴定液一直下降到活塞处才到达终点,能否据此得出准确的滴定结果_______________(填“能”或“不能”)。
(4)能否改用甲基橙作指示剂(填“能”或“不能”) _______________,如果用甲基橙作指示剂,则测定结果如何?_______________(填“偏高”“偏低”或“正确”)。
(1)图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度相差1 mL,如果刻度A为6,量筒中液体的体积是_________mL。
(2)图Ⅱ表示50 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积_________(填字母)。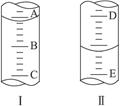
A.a mL B.(50-a) mL C.>a mL D.大于(50-a) mL
(3)若图Ⅰ表示50 mL滴定管中液面位置,A与C刻度间相差1 mL,如果刻度A为6,则液面读数为______________mL。