研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1;
C(石墨)+CO2(g)==="2CO(g)" ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3(s)的热化学方程式为________________________
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①该反应的平衡常数表达式为K=_____________。
②取一定体积的CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图Z76(a)所示,则该反应的ΔH________0(填“>”“<”或“=”)。
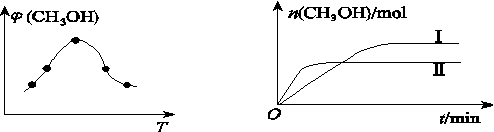
(a) (b)
图Z76
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间的变化关系如图(b)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KI________KⅡ(填“>”“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为:____________
2NH3+CO2  CO(NH2)2+H2O当氨碳比
CO(NH2)2+H2O当氨碳比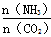 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_________。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_________。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为________。
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________________
(2)硫酸铜溶液可以加快氢气生成速率的原因是__________________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________。
(11分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源之一。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式:
________________________________________________________________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是______________。
(3)控制城市空气污染源的方法可以有___________________________________(填字母序号)。
| A.开发氢能源 | B.使用电动车 | C.植树造林 | D.戴上呼吸面具 |
(14分)在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)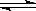 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=_______,c(I2)=_______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”) (3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
(9分)氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术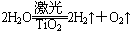 。制得的氢气可用于燃料电池。试完成下列问题:
。制得的氢气可用于燃料电池。试完成下列问题:
(1)太阳光分解海水时,实现了从_______能转化为_______能,二氧化钛作________。生成的氢气,用于燃料电池时,实现________能转化为________能。水分解时,断裂的化学键有________,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:H2+O2--2e-===H2O;B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(13分) A、B、C、D是短周期元素的单质,其原子序数按D、A、B、C的顺序依次增大。B、D在通常情况下为气体。C、D是同一主族元素的单质。J是一种无色液体。B、E均为组成空气的成份。F的焰色反应呈黄色。在一定条件下,各物质之间的相互转化关系如下图所示(图中部分产物未列出):
请填写下列空白:
⑴A是,C是,F是,G是。
⑵H与盐酸反应生成E的离子方程式是。
⑶反应①的化学方程式是。
⑷反应②的化学方程式是。每生成1 molD,转移电子的物质的量是。
⑸若反应①、②生成的B和D恰好完全反应生成J,则参加反应的F和G的物质的量之比是。