在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题: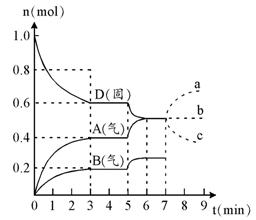
1、从反应开始到第一次达到平衡时,A物质的平均反应速率为 mol/L·min。
2、根据右图写出该反应的化学方程式 ,该反应的平衡常数表达式为K = 。
3、第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应的正反应是 (填“放热”或“吸热”)反应,反应的平衡常数 (填“增大”、“减小”或“不变”。下同),B的反应速率 。
4、若在第7分钟时增加D的物质的量,A的物质的量变化正确的是 (用图中a、b、c的编号回答)
(1)完全燃烧乙烷、丙烯、丁炔各1 mol,生成的的质量相等,需要氧气最多的是。1 mol丙烯和HCl气体发生加成反应后能和mol Cl2发生取代反应。1 mol某不饱和烃可以和1 molCl2发生加成反应,生成2,3-二氯-2-甲基戊烷,该不饱和烃结构简式为,其系统命名为。
(2)写出下列化学方程式并按要求完成填空:
①甲苯→TNT;
反应类型:_________________
②氯乙烯→聚氯乙烯;
反应类型:_________________
③丙烯→2-溴丙烷;
④CaC2→乙炔。
乙炔的电子式:_________________
⑤乙烯→乙醇。
乙醇中官能团的名称:________________;乙醇中官能团的电子式:________________
苯环上原有取代基对苯环上再导入另外取代基的位置有一定影响。其规律是:
(1)苯环上新导入的取代基的位置主要决定于原有取代基的性质;
(2)可以把原有取代基分为两类:
①原取代基使新导入的取代基进入苯环的邻、对位;如:-OH、-CH3(或烃基)、-Cl、-Br等;②原取代基使新导入的取代基进入苯环的间位,如:-NO2、-SO3H、-CHO等。
现有下列变化:(反应过程中每步只能引进一个新的取代基)
(1)请写出其中一些主要有机物的结构简式:
ABDE
(2)写出①②两步反应方程式:
①,
②。
质子核磁共振谱(PMR)是研究有机物结构的重要方法之一。在研究的化合物分子中:所处环境完全相同的氢原子在PMR谱中出现同一种信号峰:如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。又如CH3-CHBr=CHX存在着如下的两种不同空间结构: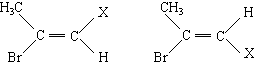
因此CH3-CHBr=CHX的PMR谱上会出现氢原子的四种不同信号峰。
请填写下列空白:
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该有机物结构简式可能为:;。
(2)测定CH3CH=CHCl时:能得到氢原子给出的信号峰6种:由此可推断该有机物一定存在种不同的结构:其结构式分别为:。
在新制的氯水参加的反应中,有如下几种情况:
(1)向KBr溶液中加入氯水,氯水中起作用的主要微粒是,
反应的离子方程式是。
(2)向AgNO3溶液中加入氯水,氯水中起作用的主要微粒是,
反应的离子方程式是。
(3)向氯水中滴加石蕊试液,溶液变红,起作用的微粒是,然后又褪色,起作用的微粒是,
已知A、B、C、D、E、F是含有同一种元素的化合物,其中A为红棕色气体, F能使红色湿润石蕊试纸变蓝色。它们之间能发生如下反应:
① A+H2O → B+C② C+F → D③ D+NaOH 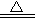 E+ F↑+H2O
E+ F↑+H2O
(1)写出它们的化学式:D,F。
(2)写出①反应的化学方程式:,
此反应中氧化剂是,还原剂是。
(3)写出反应③的离子方程式:。
(4)工业生产C的过程中有如下一步反应:即F经催化氧化生成B和H2O,写出该步反应的化学方程式:。