在一体积固定的密闭容器中,某化学反应2A(g)  B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |
 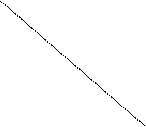 时 间 时 间浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内,用A表示表示该反应的平均速率
为_ mol/(L . min)
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_______________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1
(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。
理由是___________________________________________________________
(5)根据以上实验请指出要加快该反应可采取什么样的方法(列举方法最少2种)
_________ __________________________________________________
向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察下图所记录的现象,判断各瓶注入的液体是什么,将注入液体的编码填入图下方相应的括号中。
A.AgNO3溶液B.NaOH溶液C.水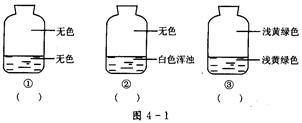
现有几种物质的熔点数据如下表:
| A组 |
B组 |
C组 |
D组 |
| 金刚石:3 550℃ |
Li:181℃ |
HF:-83℃ |
NaCl:801℃ |
| 硅晶体:1 410℃ |
Na:98℃ |
HCl:-115℃ |
KCl:776℃ |
| 硼晶体:2 300℃ |
K:64℃ |
HBr:-89℃ |
RbCl:718℃ |
| 二氧化硅1 723℃ |
Rb:39℃ |
HI:-51℃ |
CsCl:645℃ |
据此完成下列问题:
(1)A组属于_______________晶体,其熔化时克服的粒子间的作用力是_______________。
(2)B组晶体共同的物理性质是_______________ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于______________________________。
(4)D组晶体可能具有的性质是_______________ (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为Na mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为________ g·mol-1。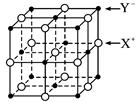
白磷分子中P—P键易断开,若一个白磷分子中每个P—P键断开插入一个氧原子,则一共可结合____________个氧原子,这样得到磷的一种氧化物,其分子式为________________。
1)图3-16为干冰的晶胞结构,观察图形,确定在干冰中每个CO2分子周围有__________个与之紧邻且等距离的CO2分子。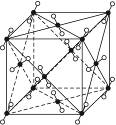
图3-16
在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为___________
_________,反应的化学方程式是______________________________。
(2)下列三种晶体①CO2 ②CS2 ③SiO2的熔点由高到低的顺序是__________>__________>__________(用序号填空),其原因是______________________________。
甲、乙、丙、丁为前三周期元素形成的粒子,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是______________________________。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
________________________________________。
(3)在一定条件下,甲与O2反应的化学方程式是______________________________。
(4)丁的元素符号是__________,它的原子结构示意图为__________。
(5)丁的氧化物的晶体结构与__________的晶体结构相似。