图Ⅰ是小红按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味。于是小明对原实验装置进行了改进,装置如图Ⅱ。

【实验操作】
.向
三支试管中分别加入5
的蒸馏水,各滴入1~2滴无色酚酞溶液,振荡,观察溶液颜色。
.在
试管中分别加入2
浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将
试管放置在盛有热水的烧杯中,观察几分钟。
【分析讨论】:
⑴
试管放有酚酞溶液的目的是。
⑵进行操作
时观察到的现象是。
⑶由此可以得到的实验结论是①,②。
⑷对比改进前的实验,改进后实验的优点是。
实验室利用如图所示装置进行相关实验,请回答下列问题:
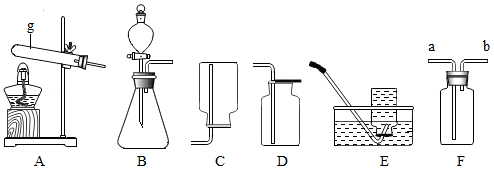
(1)指出图中仪器g的名称 。
(2)实验室制取二氧化碳,发生反应的化学方程式 。
(3)实验室常用加热氯化铵和熟石灰的混合物的方法制取氨气,由于氨气极易溶于水,且密度比空气小,所选择的发生装置为 。
(4)如用F装置收集氢气,气体应从 进入。(填"a或b")
根据如图装置,结合所学化学知识回答问题。

(1)写出仪器①的名称 ;
(2)实验室制取氧气的方法有多种方法,从“低碳”角度分析,最佳方法是(用化学方程式表示): ;若用装置C收集氧气,验满的方法为: ;
(3)在实验室可以用加热固体无水醋酸钠和固体碱石灰的方法制取甲烷。通常情况下,甲烷的密度比空气小,难溶于水,实验室制取甲烷选择的发生装置是 (填字母);若用F装置收集甲烷,气体应从 口进入(填“a”或“b”)。
增氧剂可用于给鱼池增氧,某化学兴趣小组对某种增氧剂的增氧原理进行实验探究。
【查阅资料】该增氧剂的主要成分是过碳酸钠,过碳酸钠是一种白色晶体,化学式可以表示为2Na 2CO 3•3H 2O 2。过氧化氢溶液常温较稳定,能缓慢分解,受热容易分解。
【提出问题】增氧剂真的能增氧吗?
【初次探究】取少量增氧剂于试管中,加入足量蒸馏水,观察到固体完全溶解,形成无色溶液,无气泡产生;加热,产生大量气泡。
【作出猜想】该兴趣小组结合资料和实验现象推测增氧剂溶于水后生成Na 2CO 3和H 2O 2。
【再次探究】该兴趣小组进行如表实验:
|
实验操作 |
实验现象 |
实验结论 |
|
|
(1) |
另取少量增氧剂于试管中,加入足量蒸馏水,待其完全溶解,再加入 ,将带火星的木条伸入试管内 |
|
溶液中含有H 2O 2。该操作中H 2O 2参与反应的化学方程式为 |
|
(2) |
待步骤(1)完全反应后,将所得物质过滤,取少量滤液于另一支试管中,加入 |
产生白色沉淀 |
溶液中含有Na 2CO 3 |
【得出结论】该增氧剂的增氧原理为 。
【评价反思】该增氧剂的保存方法为 。
实验室现有氯酸钾、二氧化锰、稀硫酸、石灰石、稀盐酸、锌粒以及如图仪器及装置,据图回答问题:

(1)利用上述仪器和药品制取CO2,选择的仪器是 (填序号)。
(2)利用上述仪器和药品制取O2,还缺少一种仪器,其名称为 。该反应的化学方程式为 。
(3)如果用装置⑨采用排空气法收集H2,则H2从导管口 进入(填“a”或“b”)。
以黄铜矿(主要成分为CuFeS2)为原料,采用生物炼铜是现代炼铜的新工艺,同时还可以获得绿矾(FeSO4•7H2O),流程如图:

(1)步骤①中的化学方程式:4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+ 。
4CuSO4+2Fe2(SO4)3+ 。
(2)步骤②中的反应有两个:反应一是Fe+Fe2(SO4)3═3FeSO4,该反应属于 (填基本反应类型),反应二的化学方程式为 。
(3)加入的A是 (填化学式)。
(4)获得绿矾的“一系列操作”为:蒸发浓缩、 、过滤等。