增氧剂可用于给鱼池增氧,某化学兴趣小组对某种增氧剂的增氧原理进行实验探究。
【查阅资料】该增氧剂的主要成分是过碳酸钠,过碳酸钠是一种白色晶体,化学式可以表示为2Na 2CO 3•3H 2O 2。过氧化氢溶液常温较稳定,能缓慢分解,受热容易分解。
【提出问题】增氧剂真的能增氧吗?
【初次探究】取少量增氧剂于试管中,加入足量蒸馏水,观察到固体完全溶解,形成无色溶液,无气泡产生;加热,产生大量气泡。
【作出猜想】该兴趣小组结合资料和实验现象推测增氧剂溶于水后生成Na 2CO 3和H 2O 2。
【再次探究】该兴趣小组进行如表实验:
实验操作 |
实验现象 |
实验结论 |
|
(1) |
另取少量增氧剂于试管中,加入足量蒸馏水,待其完全溶解,再加入 ,将带火星的木条伸入试管内 |
|
溶液中含有H 2O 2。该操作中H 2O 2参与反应的化学方程式为 |
(2) |
待步骤(1)完全反应后,将所得物质过滤,取少量滤液于另一支试管中,加入 |
产生白色沉淀 |
溶液中含有Na 2CO 3 |
【得出结论】该增氧剂的增氧原理为 。
【评价反思】该增氧剂的保存方法为 。
食盐是生活中的必需品,但是通过海水晾晒得到的粗盐中往往含有可溶性杂质和泥沙等不溶性杂质而不能直接食用。某校化学兴趣小组的同学欲进行粗盐(含有难溶性杂质)提纯实验。同学们做粗盐提纯实验的操作示意图如图:
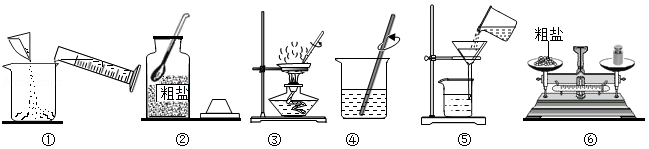
请回答下列问题:
(1)操作③的名称是 。
(2)操作④中用玻璃棒进行搅拌,其作用是 。
(3)操作⑤中有一处明显的错误,请你帮他们指出来 。
(4)粗盐提纯实验的正确操作顺序为 (填操作示意图的序号)。
(5)操作③中,当观察到 时,停止加热。
某化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验:
实验一:取5mL氢氧化钠溶液于烧杯中,滴入几滴酚酞溶液,可观察到现象为 ,然后加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为 。
实验二:对实验一反应后溶液中的溶质进行探究。
【提出猜想】
猜想一:只有NaCl
猜想二:有NaCl和NaOH
猜想三:有NaCl和HCl
你认为猜想 不合理,其理由是 。
【设计实验】
|
实验操作 |
实验现象 |
实验结论 |
|
取反应后的溶液于试管中,加入 |
|
猜想三成立 |
【拓展应用】我国土壤的酸碱性有“南酸北碱”之说法,你认为需向酸性土壤中加入 进行改良。
如图是实验室制取常见气体及检验相关性质的装置图,据图回答问题。

(1)指出①④装置中标号仪器的名称:X. ,Y. 。
(2)用过氧化氢溶液与二氧化锰混合制取氧气时,需要选用的发生装置是 (填装置序号,下同),反应的化学方程式为 。
(3)二氧化碳的收集装置可选用 ,二氧化碳的检验装置可选用 ,检验二氧化碳的化学方程式 。
(4)实验室常用加热无水醋酸钠与碱石灰固体混合物的方法来制取甲烷气体。要制取并收集甲烷 (密度比空气小,难溶于水),可选用的发生、收集装置依次是 。
(1)倾倒液体时,细口瓶标签的一面朝向 处,细口瓶的塞子要 在桌面上。
(2)量液体时,量筒必须放平,视线要与量筒内液体 液面的最低处保持水平,再读出液体的体积。
将一定量的K2CO3溶液与BaCl2溶液混合,过滤反应后的混合物。某兴趣小组的同学们欲探究滤液中溶质的组成。请你一同参与探究并回答有关问题:
【查阅资料】K2CO3溶液显碱性;BaCl2、KCl溶液显中性。
【提出猜想】猜想1:滤液溶质是KCl;
猜想2:滤液溶质是 ;
猜想3:滤液溶质是KCl和K2CO3。
【实验探究】
|
实验操作 |
实验现象 |
实验结论 |
|
①取少量滤液于试管中,滴几滴无色酚酞试液,振荡 |
无明显现象 |
猜想 不成立 |
|
②另取少量滤液于另一支试管中,滴加 K2CO3溶液 |
|
猜想2成立。写出相关的化学方程式:
|
【问题讨论】小丽同学认为要证明猜想2成立也可改用AgNO3溶液,你认为小丽同学___ (填“能”或“不能”)达到实验目的。
【反思拓展】实验结束后,组内同学认为K2CO3是盐而其水溶液却显碱性,这可能与它的构成微粒有关,微粒符号是 。