著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”。已知:稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4;氧化性:Ce4+>Fe3+。)下列说法正确的是
A.四种核素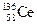 、 、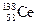 、 、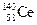 、 、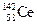 ,它们互称为同素异形体 ,它们互称为同素异形体 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI ="==" CeI4 + 2H2↑ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
| D.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ ="==" Ce3+ + 2Fe3+ |
下列关于一些元素化合物的性质叙述正确的是()
| A.将SO2通入品红溶液、KMnO4溶液,溶液皆褪色,若加热,溶液颜色皆复原。 |
| B.明矾具有净水功能,可除去碱性废水或酸性废水中的悬浮颗粒 |
| C.实验室可用烧碱溶液处理含SO2和C12的废气 |
| D.可用澄清的石灰水来鉴别碳酸钠与碳酸氢钠溶液 |
下列排列顺序完全正确的组合是()
①溶解性:Na2CO3>NaHCO3>AgCl>AgI
②氧化性:MnO2>Cl2>Fe3+>Cu2+
③常温下,α1、α2、α3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,则α1=α2>α3
④同温下,1L0.5mol·L-1NH4Cl溶液中NH4+数与2L0.25mol·L-1NH4Cl溶液中NH4+数分别为a、b,则a>b
| A.①②③ | B.②③④ | C.①③④ | D.①②④ |
已知25℃时,AgI和AgCl饱和溶液中c(Ag+)分别为1.22×10-8mol·L-1和1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L-1的混合溶液中,滴加等体积等物质的量的浓度的AgNO3溶液。下列叙述不正确的是()
| A.溶液中先产生的是AgI沉淀 |
| B.AgCl的Ksp为1.69×10-10 |
| C.混合溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| D.若在AgI悬浊液中滴加少量的KCl溶液,黄色溶液不会转变成白色沉淀 |
下列说法正确的是()
| A.第ⅥIA族元素从上到下,其氢化物的还原性依次减弱 |
| B.同周期从左到右,非金属元素最高价氧化物对应的水化物的酸性依次增强 |
| C.第三周期元素的离子半径从左到右逐渐减小 |
| D.CCl4属于共价化合物,每个原子都满足8电子结构,其水溶液能导电 |
NA代表阿伏加德罗常数的值,下列说法正确的是()
| A.将足量的铜片与含有0.4molHNO3的浓硝酸充分反应生成NO2的分子数为0.2 NA |
| B.O2和N2的混合气22.4L中一定含有2 NA个原子 |
| C.某醋酸钠溶液中含有1molCH3COO—离子,则Na+数目等于NA |
| D.14 g链烃(分子通式为CnH2n,n≥2)中含有的C=C键数目一定为NA/n |