常见的晶体有如下类型:①分子晶体 ②离子晶体 ③原子晶体 ④金属晶体,由非金属元素所形成的单质或化合物中,固态时的晶体类型可以是( )
| A.只有①②③ | B.只有①③④ | C.①②③④ | D.只有①③ |
下列物质长期放置在空气中容易变质,但不属于氧化还原反应的是 ( )
| A.CaO | B.Na2O2 | C.Na2SO3 | D.FeSO4 |
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源 ③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 ④不锈钢和目前流通的硬币都是合金 ⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 ⑥豆浆和雾都是胶体。上述说法正确的是 ( )
| A.①②④ | B.①⑤⑥ | C.①③④⑥ | D.②③④⑤ |
下列化学用语正确的是()
A.含有10个中子的氧原子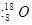 |
B.乙烯的最简式(实验式):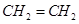 |
C.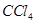 的电子式: 的电子式: |
D.铝离子的结构示意图 |
盛有氯化钡稀溶液的甲、乙两试管分别通入SO2至饱和,若向甲试管中加入足量过氧化钠,乙试管中加入足量氨水,则下列叙述正确的是:
A甲、乙两试管都有白色沉淀生成 B甲、乙两试管都没有白色沉淀生成
C甲试管没有白色沉淀生成而乙试管有 D甲试管有白色沉淀生成而乙试管没有
有关NaHCO3与Na2CO3的说法正确的是
A Na2CO3俗称纯碱,所以Na2CO3属于碱
B 将石灰水加入到NaHCO3溶液中不产生沉淀
C NaHCO3遇到盐酸放出CO2的反应要比Na2CO3剧烈
D 等质量的NaHCO3和Na2CO3与足量的盐酸反应,在相同条件下Na2CO3产生的CO2的体积大