在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
下表所列各组第Ⅰ栏中的化学反应与第Ⅱ栏中的化学反应,都可以用第Ⅲ栏中的离子方程式表示的是( )。
| 选项 |
第Ⅰ栏 |
第Ⅱ栏 |
第Ⅲ栏 |
| A |
往少量NaOH溶液中投入铝片 |
往过量NaOH溶液中投入铝片 |
2Al+2OH-+ 2H2O=2AlO +3H2↑ |
| B |
往Fe2(SO4)3溶液中滴入NaOH溶液 |
往Fe2(SO4)3溶液中滴入Ba(OH)2溶液 |
Fe3++3OH-=Fe(OH)3↓ |
| C |
往NaHCO3溶液中滴入Ca(OH)2溶液 |
往NaHCO3溶液中滴入NaOH溶液 |
OH-+HCO3-=CO32-+H2O |
| D |
往NaOH溶液中通入过量CO2气体 |
往NaOH溶液中通入少量CO2气体 |
CO2+OH-=HCO3- |
向含有下列各组离子的溶液中通入相应气体后,能大量共存的是( )。
| A.通入NO2:Na+、Fe2+、Cl-、SO42- |
| B.通入NH3:AlO2-、NH4+、Na+、NO3- |
| C.通入Cl2:K+、NH4+、I-、Cl- |
| D.通入CO2:Na+、K+、NO3-、SiO3- |
下列说法正确的是( )。
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强 CuSO4+H2↑可推出Cu的还原性比H2的强 |
| B.在反应CaH2+2H2O=Ca(OH)2+2H2↑中,水作氧化剂 |
| C.反应3NO2+H2O=2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1 |
| D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3=2NaIO3+Cl2不能发生 |
下列各组物质中只具有还原性的是 ( )。
| A.F-、CO、Na | B.Na、I-、Zn |
| C.Fe3+、SO42-、NO3- | D.Fe3+、O2、H2O2 |
如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是()。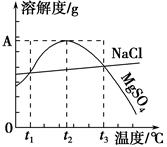
| A.只有在t1℃时,NaCl和MgSO4的溶解度才相等 |
| B.t1℃~t2℃,MgSO4的溶解度随温度升高而减小 |
| C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大 |
| D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,溶液的物质的量浓度减小 |