E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系: xM (g) Mx(g ),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确
Mx(g ),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确 的是( )
的是( )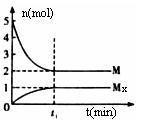
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.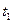 时刻,保持温度不变,再充入1molMx,重新 时刻,保持温度不变,再充入1molMx,重新达到平衡时, 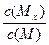 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液,这种试剂是
| A.氢氧化钠溶液 | B.氢氧化铜悬浊液 |
| C.石蕊试液 | D.碳酸钠溶液 |
下列反应不能引入羟基的是
| A.还原 | B.酯化 | C.加成 | D.水解 |
为防止有机物挥发,可加一层水保存,即水封。下列有机物中,既能用水封法保存,又能发生水解和消去反应的是
| A.乙醇 | B.溴乙烷 | C.乙酸乙酯 | D.四氯化碳 |
如图是常见四种有机物的比例模型示意图。下列说法正确的是
| A.甲的二氯代物只有一种 |
| B.乙不能与溴水发生反应而使溴水褪色 |
| C.1mol丙中含有碳碳双键的数目是3NA |
| D.丁在稀硫酸作用下可与甲酸发生取代反应 |
下列化学用语不正确的是
| A.葡萄糖的实验式: CH2O | B.甲醛的结构式: |
C.羟基的电子式: |
D.乙醛的分子式: CH3CHO |