下列说法或表示方法中正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2 |
| B.由C(石墨)→C(金刚石);ΔH=+1.9KJ/mol ,可知1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,即金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol |
| D.放热及熵增加的反应,一定能自发进行 |
已知:H2(g)+F2(g)=2HF(g)△H=-539kJ/mol,若断裂1mol H—H键需吸收436kJ的能量,断裂1mol F—F键需吸收155kJ的能量,则断裂1 mol H—F键需吸收的能量为
| A.565kJ | B.282.5kJ | C.765kJ | D.380kJ |
已知反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,下列各组实验中最先出现浑浊的是
| 组号 |
温度 |
Na2S2O3 |
H2SO4 |
H2O |
||
| 体积 |
浓度 |
体积 |
浓度 |
体积 |
||
| A |
0℃ |
10mL |
0.1 mol/L |
10mL |
0.1 mol/L |
0mL |
| B |
10℃ |
5mL |
0.1 mol/L |
5mL |
0.1 mol/L |
10mL |
| C |
30℃ |
5mL |
0.1 mol/L |
5mL |
0.1 mol/L |
10mL |
| D |
30℃ |
5mL |
0.2 mol/L |
5mL |
0.2 mol/L |
10mL |
在恒温恒容的密闭容器中,对可逆反应2SO2(g)+O2(g)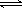 2SO3(g),下列判断不正确的是
2SO3(g),下列判断不正确的是
A.达到化学平衡时,2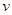 正(O2)= 正(O2)=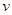 逆(SO3) 逆(SO3) |
| B.若单位时间内生成x molSO3的同时消耗x mol SO2,则反应达到平衡状态 |
| C.达到化学平衡时,容器中气体压强不再变化 |
| D.达到化学平衡时,容器中混合气体的平均相对分子质量不再变化 |
其他条件不变时,改变下列条件,可以使活化分子百分数增加,从而加快反应速率的是
①增大反应物浓度②升高温度③加入正催化剂④增大压强(有气体参加)
| A.①② | B.①④ | C.②③ | D.③④ |
某温度下,浓度都是1.0mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z。10min后测得X2、Z的浓度分别为0.4mol/L、0.6mol/L,则该反应的化学方程式可能为
A.X2+2Y2 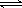 2XY2 2XY2 |
B.3X2+Y2 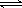 2X3Y 2X3Y |
C.2X2+Y2 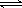 2X2Y 2X2Y |
D.X2+3Y3 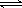 2XY3 2XY3 |