在其他条件不变时,改变某一条件对A2(g)+3B2(g)=2AB3(g) 化
学平衡状态的影响,得到如右图所示的变化规律(图中T表示
温度)。下列结论正确的是( )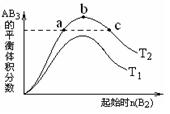
A.a、c两点A2的转化率相等
B.正反应一定是吸热反应,且T2>T1
C.b点时,平衡体系中A、B原子数之比为1:3
D.向a点的平衡体系中加入A2,可达到b点的平衡状态
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是()
| A.Na和O2 | B.NaOH和CO2 | C.NaHCO3和NaOH | D.Na2CO3和HCl |
下列反应中,生成物的总能量大于反应物总能量的是()
| A.氢气在氧气中燃烧 | B.铁丝在氧气中燃烧 |
| C.硫在氧气中燃烧 | D.焦炭在高温下与水蒸气反应 |
下列过程一定释放出能量的是()
| A.化合反应 | B.分解反应 |
| C.分子拆成原子 | D.原子组成分子 |
下列说法正确的是()
| A.需加热方能发生的反应一定是吸热反应 |
| B.放热的反应在常温下一定很易发生 |
| C.反应是吸热还是放热必须看反应物和生成物具有的总能量的相对大小 |
| D.吸热反应在一定条件下也能发生 |
根据化学反应的实质是旧键断裂新键形成这一事实,下列变化不属于化学反应的是( )
| A.白磷在260℃时转化为红磷 |
| B.石墨在高温下转化为金刚石 |
| C.NaCl熔化 |
| D.五氧化二磷吸水 |