实验室中有一瓶KCl和CaCl2的固体混合物,通 过下列操作可确定该混合物中KCl和CaCl2的质量比,也可制得纯净的KCl。
过下列操作可确定该混合物中KCl和CaCl2的质量比,也可制得纯净的KCl。
请回答下列问题:
①调整零点时,若指针偏向左边,应将右边的螺丝帽向 移动(填左或右)。某学生用已知质量为Yg的表面皿,准确称取Wg样品。他在托盘天平的右盘上放入(W+Y)g砝码,在左盘的表面皿上加入样品,此时指针偏向如图,接下来他的操作应为
。
②实验过程中,加入的A是 ,检验A是否过量的方法是
。加入的B是 ,B物质需要过量的理由是
。得到的固体C是 ,检验沉淀C是否洗净的方法是 。
③过滤时,某学生的操作如图,请用文字说明图中操作的错误
。
④该混合物中KCl与CaCl2质量比的计算式为
氯碱工业中电解饱和食盐水的原理示意图如下图所示: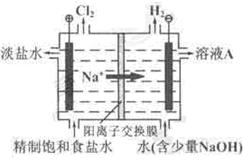
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来自电解池):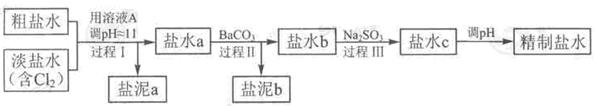
①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3盐水b ,至多添加10% Na2SO3溶液kg(溶液体积变化忽略不计)。
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2(1)
平均反应速率的计算式为v(S2O82-)=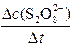 。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 ="" S4O62-+ 2I-(2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
|
试剂 用量 (mL) |
0.20 mol·L-1(NH4)2S2O8溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
| 0.20 mol·L-1 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
| 0.010 mol·L-1 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
| 0.2% 淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
| 0.20 mol·L-1KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
| 0.20 mol·L-1(NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
| 20 ℃时,反应时间Δt(s) |
32 |
67 |
130 |
66 |
135 |
|
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是。
(3)第①组实验的v(S2O82-)=mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。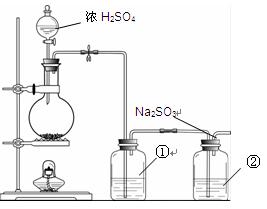
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
①;
②。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:。
现有A、B、C、D、E五种化合物,它们都是由下表中阴阳离子组合而成。
| 阳离子 |
A13+、Ba2+、Ag+ |
| 阴离子 |
C1-、SO42-、OH- |
为了鉴别它们,分别进行了以下实验,记录如下:
①.A和D都不溶于水,也不溶于稀硝酸;
②.B溶于水后,与上述某阳离子反应可生成A,且B溶液与过量氨水反应生成白色沉淀
③.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀。
④.E溶于水后,与上述某阴离子反应可生成A;
⑤.B溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀部分溶解。
(1)根据上述实验结果,写出各物质的化学式:
C, D, E。
(2)请写出在B溶液中加入过量E溶液对应的离子方程式:
(1)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑+ CO2↑+ H2O,下列装置中,可用作草酸分解制取气体的是(填序号)
CO↑+ CO2↑+ H2O,下列装置中,可用作草酸分解制取气体的是(填序号)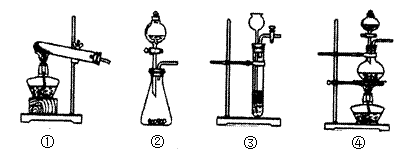
(2)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。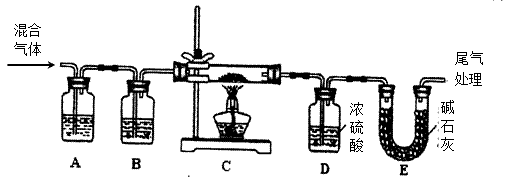
①、为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是、。
②、在点燃C处酒精灯之前,应先持续通入一段时间的混合气体,其目的是
③、准确称量样品的质量20.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为16.64g,D中浓硫酸增重1.44g,则n=。
④、在本实验中,下列情况会使测定结果n偏大的是(填字母)
a.缺少装置A b.缺少装置Bc.反应后固体是铁和少量Fe2O3·nH2O
掌握实验室药品的贮存方法,仪器的名称、组装及操作使用是中学化学实验的基础,下图为两套实验装置: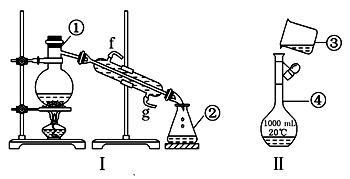
(1)KMnO4通常保存在棕色试剂瓶中,下列试剂不需用棕色试剂瓶保存的是(填字母代号)。
a.浓硝酸 b. 氯水 c. 烧碱溶液
(2)写出下列仪器的名称:① ,④ .
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为
(4)现需配制250 mL 0.2 mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的存在的错误是:
①,②;