把3 mol M和2.5 mol N混合于2 L的密闭容器中,发生反应的化学方程式为:
3M(g) + N(g) 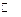 xP(g) + 2Q(g),5min后反应达到平衡,若反应前后温度不变,容器内压强变小,已知
xP(g) + 2Q(g),5min后反应达到平衡,若反应前后温度不变,容器内压强变小,已知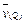 = 0.1mol·L-1·min-1,则下列说法错误的是( )
= 0.1mol·L-1·min-1,则下列说法错误的是( )
| A.M的平均反应速率为0.15 mol·L-1·min-1 |
| B.平衡时N的转化率为25% |
| C.平衡时P的浓度为0.25 mol·L-1 |
D.平衡时容器内的压强为原来的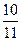 倍 倍 |
下列说法不正确的是()
| A.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.用热的纯碱溶液洗碗可去除油污 |
| D.工业实际生产金属镁可由电解熔融的MgO 得到 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.3mol NO2与水充分反应,转移nA个电子 |
| B.常温常压下,18g H2O含有3nA个原子 |
| C.1L 0.1 mol·L-1NaHCO3溶液中含有0.1nA个HCO3- |
| D.标准状况下,2.24L乙醇含有0.1nA个CH3CH2OH分子 |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
Si有良好的半导体性能 |
Si可用于制备光导纤维 |
| B |
铁比铜活泼 |
铜板上的铁钉在潮湿空气中容易生锈 |
| C |
蛋白质和淀粉都是高分子化合物 |
蛋白质和淀粉水解最终产物均是葡萄糖 |
| D |
汽油和植物油都属于烃 |
汽油和植物油都可以燃烧 |
已知: Cu (s)+2H+(aq)=Cu2+(aq)+ H2(g)△H 1
2H2O2(l)=2H2O(l) + O2 (g)△H 2
2H2(g) + O2(g)=2H2O(l)△H 3
则反应 Cu (s)+H2O2(l)+2H+ (aq)=Cu2+(aq)+ 2H2O(l) 的△H是
A.△H=△H 1+ △H 2+ △H 2+ △H 3 △H 3 |
B.△H=△H 1+ △H 2- △H 2- △H 3 △H 3 |
| C.△H=△H 1+2△H 2+2△H 3 | D.△H=2△H 1+△H 2+△H 3 |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是
| A.R位于元素周期表中第二周期第IVA族 |
| B.五种元素中原子半径最大的是X |
| C.气态氢化物稳定性:Y>T |
| D.Z元素的最高价氧化物对应的水化物的化学式为HZO4 |