(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为 或 。
若温度为25℃时,体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和.已知Va>Vb,且a=0.5 b,则a的取值范围 。
(3)若将此温度(t℃)下,pH=11的苛性钠溶液m L与pH=1的稀硫酸溶液nL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小。
①若所得混合液为中性,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
②若所得混合液的pH=2,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
(1)烷烃分子CnH20中,n值应为,相对分子质量为128的烷烃的分子式为,碳、氢的质量比为9:2的烷烃,其结构简式为。
(2)某气态烃在标准状况下的密度是1.34g/L,其相对分子质量为,在该烃中碳的质量分数为80%,则其分子中碳、氢原子的个数比为,化学是为。
有机化合物F是合成电子薄膜材料高聚物Z和增塑剂P的重要原料。
(1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。
① 3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、“II”或“III”)。
② X的结构简式是。
③ 1 mol F在O2中充分燃烧,消耗7.5 mol O2,生成8molCO2和3molH2O,1mol F与足量NaHCO3溶液反应生成2 mol CO2。其分子内的氢原子处于3种不同的化学环境。
F分子中含有的含氧官能团的名称是。
Y+F→Z反应的化学方程式是。
(2)已知: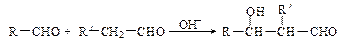 (R、R'代表烃基或氢原子)。合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个—CH3。
(R、R'代表烃基或氢原子)。合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个—CH3。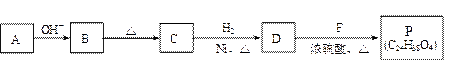
① A→B反应的化学方程式是。
② B→C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氢原子。C的结构简式是。
③ P的结构简式是。
④ 符合下列条件的B的同分异构体共有(填数字)种。
a.在酸性条 件下水解为M和N b.一定条件下M可以转化为N
件下水解为M和N b.一定条件下M可以转化为N
芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。并且各有机物间存在如下转化关系:
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)C中所含官能团的名称是。
(2)A的分子式是。B的结构简式是。
(3)完全燃烧时,1 mol D与1 mol 下列的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(4)C与F反应的化学方程式是,反应类型是____________。
(5)水杨酸 的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式:。
的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式:。
有关元素X、Y、Z、W的信息如下
| 元素 |
有关信息 |
| X |
所在主族序数与所在周期序数之差为4 |
| Y |
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| Z |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| W |
地壳中含量最高的金属元素 |
请回答下列问题:
(1)W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为。
铜片、碳棒和ZX3溶液组成原电池,写出正极发生的电极反应方程式
_______________________________________________。
(2)向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为_____________________,相关反应的离子方程式为_______________________________。
(3)以上述所得WX3溶液为原料制取无水WX3,先制得WX3·6H2O晶体,主要操作包括__________________________,在_____________________条件下加热WX3·6H2O晶体,能进(4)一步制取无水WX3,其原因是(结合离子方程式简要说明)_______________________________。
以下为中学常见物质,转化关系如下。C与B溶液反应产生气体F,D可在F中燃烧,图中部分产物略去。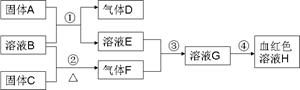
(1)写出固体C化学式;
(2)实验室用①制取D,B溶液应为溶液(“浓”或“稀”);若用②制取F,B溶液应为溶液(“浓”或“稀”)。写出②反应方程式;
(3)如何检验中的阳离子;
(4)实验室配制G溶液,操作为;
(5)除③可实现E→G外,请用其他物质实现E→G,化学方程式。