亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: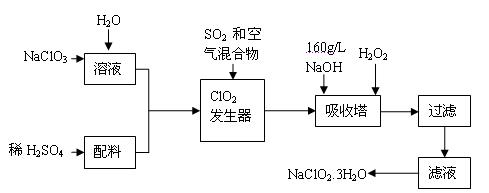
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2 3H2O。
3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个量是 (用文字说明)。
(2)发生器中鼓入二氧化硫的作用可能是 (填序号)。
A.将SO2氧化成SO3,增强酸性 B.稀释ClO2以防止爆炸;
C.将NaClO3还原成ClO2
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(4)吸收塔内的反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式: 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (填序号)。
A.Na2S B.Na2O2 C.FeCl2
(6)从滤液中得到NaClO2 3H2O粗晶体的实验操作依次是 (填序号)。
3H2O粗晶体的实验操作依次是 (填序号)。
A.蒸发 B.蒸馏 C.冷却结晶 D.灼烧 E.过滤
要得到更纯的NaClO2 3H2O晶体能否加热蒸干 (填“能”或“不能”)。
3H2O晶体能否加热蒸干 (填“能”或“不能”)。
在一定条件下可实现下图所示物质之间的变化
请填写以下空白:
(1)孔雀石的主要成份是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。上图中的F是 。
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式
(3)图中所得G和D都为固体混合后在高温下可发生反应写出该反应化学方程式 。
(4)每生成1mol D同时生成 mol E。
某地有一池塘,生长着丰富的水生植物和多种鱼虾。后来,由于化工厂将大量污水排入池塘中,使水质恶化,各种水生生物先后死亡。根据题意回答下列问题:
(1)从生态平衡角度看,池塘这种变化说明了。
(2)造成这种变化的原因是。
(3)经检测,污水中含有0.012 mol·L-1的游离溴。可用亚硫酸钠除去污水中的溴,请写出其化学方程式。
(4)处理这种污水5 L,需加入0.05 mol·L-1的亚硫酸钠__________L,才能将溴全部除去。
(5)要使池塘恢复本来面目.首先要解决的问题是__________.首先要恢复的生物是__________。
根据下图所示的A、B、C、D、E 五种物质的相互转化关系,按如下关系填写相应的物质和有关反应的化学方程式:
(1)当A是气体单质时,B是_________,C是____________,E是______________,由D 生成E的反应的化学方程式是__________________。
(2)当A是固体单质时,A是_________,B是____________,D是______________,由E 生成C的反应的化学方程式是__________________。
人们常用比喻的手法来描述材料的属性,比如,“薄如纸,润如玉,声如馨,明如镜”是形容中国发明的;也可借用材料的属性来丰富比喻,比如借用铜、铁的坚硬,就有了“铜墙铁壁”这类词语。下列词语中,同样借用材料硬度来构词的是
| A.金碧辉煌 | B.火树银花 | C.铜壶滴漏 | D.铁石心肠 |
根据某种分类标准,材料大体可以分为天然材料、烧炼材料、合成材料等。下面是一个分类的实例。
| 类型 |
天然材料 |
烧炼材料 |
合成材料 |
| 名称 |
木材、大理石、皮革 |
钢铁、陶瓷、铝 |
合成纤维、合成橡胶、合成塑料 |
请再选择一个分类标准,将上述材料重新分类。
| 类型 |
|
| 名称 |