(1)一个体重50 kg的健康人身体中含铁2 g。铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,利于铁的吸收,该过程中维生素C做 剂,Fe3+作 剂,维生素C的还原性______于 Fe2+(填“强”“弱”)
(2)在热的稀硫酸溶液中溶解了11.4 g FeSO4。当加入50 mL 0.5 mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
____FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NxOy + H2O
①配平该化学方程式,用单线桥标出电子转移的方向和数目。
②反应中氧化剂为 ,氮氧化物的化学式为__________
(3)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中, Fe2+离子与酸性高锰酸钾反应的离子方程式为:________________________。羟胺的氧化产物是 。
【2015山东理综化学】[化学---物质结构与性质]氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________(用离子方程式表示)。
已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_________,其中氧原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键的键能为159kJ·mol-1,Cl-Cl键的键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为______kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
【2015新课标Ⅱ卷理综化学】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为_________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。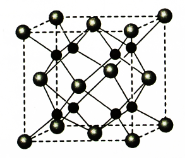
【2015新课标Ⅰ卷理综化学】[化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在基态原子中,核外存在 对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)CS2分子中,共价键的类型有 ,C原子的杂化轨道类型是 ,写出两个与CS2具有相同空间构型和键合形式的分子或离子 。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示: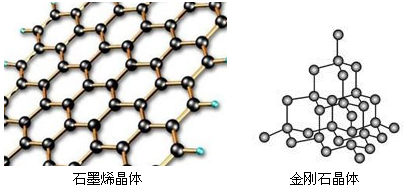
①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
【2015新课标Ⅱ卷理综化学】[化学一选修5:有机化学基础]聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下: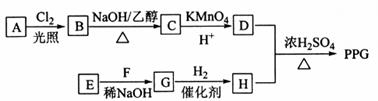
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④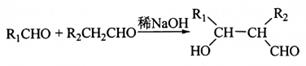 。
。
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是(写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪b.红外光谱仪 c.元素分析仪 d.核磁共振仪
【2015新课标Ⅰ卷理综化学】[化学——选修5:有机化学基础]A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示: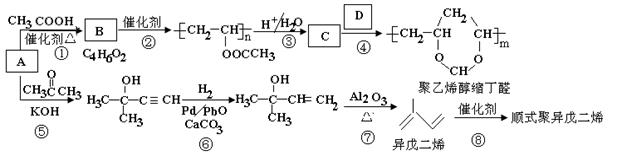
回答下列问题:
(1)A的名称是 ,B含有的官能团是 。
(2)①的反应类型是 ,⑦的反应类型是 。
(3)C和D的结构简式分别为 、 。
(4)异戊二烯分子中最多有 个原子共平面,顺式聚异戊二烯的结构简式为 。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体 (填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线 。