【2015山东理综化学】[化学---物质结构与性质]氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________(用离子方程式表示)。
已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_________,其中氧原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键的键能为159kJ·mol-1,Cl-Cl键的键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为______kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
镁砂(MgO)是一种高温耐火材料。下图是氨法制取高纯镁砂的部分工艺流程: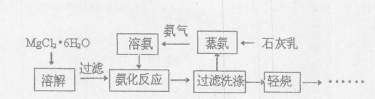
请回答:
(1)MgCl2·6H2O溶于水,溶液呈(填“酸性”、“中性”或“碱性”)。
(2)写出氨气的电子式。
(3)蒸氨是将石灰乳通人氯化铵溶液中并加热,写出该反应的化学方程式:。
(4)轻烧后的产物为。
(5)过滤洗涤主要是除去附着在固体表面的氯离子,检验沉淀已洗涤干净的方法是。
(6)氨化反应过程中反应的离子方程式为。
(7)已知向Mg(OH)2沉淀中滴加氯化铵溶液可观察到沉淀溶解,该实验应注意使用饱和氯化铵溶液、边滴加边振荡,试解释该反应发生的原理(用离子方程式表示和文字说明)。
(4分)A、B、C、D四种气体,都是大气的污染物。国家环境保护法严格禁止把这类气体大量排入空气中,工业上通常都用碱液加以吸收。已知A的水溶液是一种无氧酸,A在空气中充分燃烧得到B;B是形成酸雨的主要污染物;C是一种单质,其水溶液具有漂白作用;D是硝酸工业尾气中有害物质之一,易溶于水。根据推断结果和下列要求写出有关的化学方程式。
(1) A在空气中完全燃烧:。
(2) B的水溶液被空气氧化:。
(3) C跟消石灰反应:。
(4) D跟水反应:。
(10分)X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y。用微粒符号完成下列问题:
(1)Y、Z两种元素的最高价氧化物的水化物酸性___________强于___________。
(2)M、Z、Y形成的简单离子的半径的大小________________。
(3)M2X2固体中阴、阳离子个数比____________,其电子式为_______________。该物质中含有化学键的类型有______________和______________。
(4)将Z的单质通入YX2的水溶液中发生反应的离子方程式为____________。
(10分)在短周期元素中:①金属性最强的元素是______,与水反应最剧烈的非金属是_____;②地壳中含量最丰富的元素位于第________周期第________族,地壳中含量最多的金属元素位于周期表的第________周期第________族.
在11~18号的元素中,③原子半径最小的元素是________,阳离子半径最小的是________,阴离子半径最小的是________,④元素最高价氧化物中既能与盐酸反应又能与烧碱反应,该氧化物是________.
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有6个电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性. |
| Z |
元素最高正价是+7价 |
(1)元素T为元素(填元素名称)。元素X的一种核素可测定文物年代,这种核素的符号是。
(2)元素Y在周期表中的位置。
(3)元素Z的原子结构示意图为。
(4)元素Z与元素T相比,非金属性较强的是(用元素符号表示),能证明这一事实的依据是。
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是(填酸的化学式),理由是。