(10分)X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y。用微粒符号完成下列问题:
(1)Y、Z两种元素的最高价氧化物的水化物酸性___________强于___________。
(2)M、Z、Y形成的简单离子的半径的大小________________。
(3)M2X2固体中阴、阳离子个数比____________,其电子式为_______________。该物质中含有化学键的类型有______________和______________。
(4)将Z的单质通入YX2的水溶液中发生反应的离子方程式为____________。
(1)9.03×1023个二氧化碳的物质的量是 ,质量是 g。
(2)在100mL2mol/L硫酸溶液中,硫酸的质量是 g,氢离子的物质的量浓度为 mol/L
(3)“人造空气”(氧气O2与氦气He的混合气体)可用于减轻某病痛或供深水潜水员使用。在标准状况下,22.L“人造空气”的质量是9.6g,其中氧气与氦气的体积比为 ,氧气的质量是 g。
有下列物质:①二氧化碳②碳酸钙③氯气④醋酸⑤乙醇⑥石墨⑦氢氧化钠溶液⑧稀硫酸⑨熔融氯化钠⑩铝。请用序号回答下列问题:
(1)属于电解质的是 ,属于非电解质的是
(2)能够导电的是
(3)写出物质④的电离方程式
(1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示。试回答:
AB段曲线所表示的反应化学方程式是: 。
将B处生成的溶液煮沸,反应化学方程式是: 。
(2)已知硫可与热的KOH溶液发生反应,反应方程式如下:3S+6KOH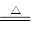 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
据此回答以下问题:
①在上述反应中,氧化剂与还原剂的物质的量之比为 。
②在上述反应中,若有3 mol硫单质参与反应,则转移电子的物质的量是 mol。
(1)一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空格:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________________。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是_________________________。
(2)常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为________mol·L-1。
(3)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为__________同学的说法正确,理由是____________________________。
(4)明矾[KAl(SO4)2·12H2O]常用作净水剂,其原理是_______________(用离子方程式表示)。
(5)将FeCl3溶液蒸干并灼烧,最终得到的固体物质是______________________(填写化学式)。
在一密闭容器中发生反应N2+3H2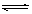 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题: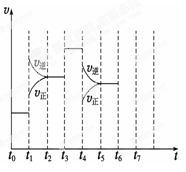
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。