现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I、甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和F eCl3溶液;
eCl3溶液;
III、丙同学向25 ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是 ;他的操作中涉及到的化学反应方程式为
(2)证明有Fe(OH)3胶体生成的实验操作及现象是
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明
②向其中加入稀硫酸,产生的现象是
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 (可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
(1)写出电解时发生反应的化学方程式:;
(2)除去ClO2中的NH3可选用的试剂是;(填序号)
A.饱和食盐水B.碱石灰C.浓硫酸D.水
(3)测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完
全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定
(I2+2S2O32-=2I- +S4O62-),共用去V mL硫代硫酸钠溶液。
①装置中玻璃液封管的作用是;
② 请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式;
③ 测得ClO2的质量m(ClO2)=。(用含c、V的代数式表示)
三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由.
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg ,则混合物中Cu2O的质量分数为。
,则混合物中Cu2O的质量分数为。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
6.0 |
7.5 |
1.4 |
| 沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择: A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案: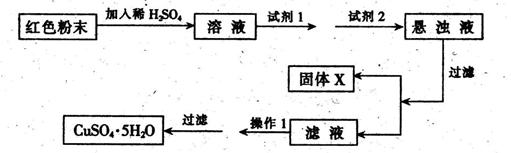
试回答:①试剂1为____,试剂2为(填字母)。
②固体X的化学式为____,③操作I为_。
黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。
(1)该过程中能循环利用的物质为。
(2)在该过程中,使用膜反应器及时分离出HI分解产生的H2,目的是(用平衡移动的原理解释)。
(3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。已知浓硫酸的沸点为338℃,加热时酒灯火焰的温度为400℃~500℃。
①甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,请解释生成该白色沉淀的可能原因(用离子方程式表示)。
②乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检查)。
a.打开弹簧夹通入N2,一段时间后关闭弹簧夹;b.滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。操作a的目的是,装置B中的剂是。
③丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,产生不溶于盐酸的白色沉淀,丙同学滴加的试剂可能是(填字母编号)。
a.NaOH溶液 b.H2O2溶液 c.新制氯水 d.酸性KmnO4溶液
④装置D中与导管连接的是硬质玻璃管,则装置D的作用是。
Ⅰ.某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。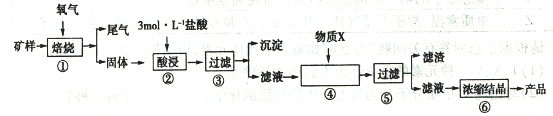
(1)在焙烧过程产生的尾气中,有一种是主要的大气污染物。若在实验室中以碱液吸收处理之,下列装置可行的是_________(填字母)。
(2)步骤②酸浸过程中,需要用到3mol·L-1,的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_________________________;
(3)步骤④中,加入的X物质可以是________,作用是_____________。
Ⅱ.已知FeSO4在高温下分解生成Fe2O3、SO3和SO2用下图所示装置设计实验,检验FeSO4在高温下分解生成的气态物质,并测定已分解的FeSO4质量.
已知:B装置、烧瓶E中所加试剂依次为氢氧化钠溶液、水(滴有数滴BaCl2溶液),请回答下列问题:
(1)D装置中所加试剂名称_____________________________________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:c→_______________→e。
(3)检验后,用烧瓶E中混合物测定已分解的FeSO4质量,此实验操作的第一步:_______________________________________________________;第二步:过滤混合物,在过滤器上将沉淀洗净后,灼烧并冷却至室温,称量其质量为ag,再次灼烧冷却至室温称量其质量为bg,且b<a,继续灼烧、冷却并称重,直到连续两次称量的质量差不超过0.1g为止。
(4)若最终得到沉淀cg,则已经分解的FeSO4质量________________(填计算式)。
自来水生产的流程示意图见下: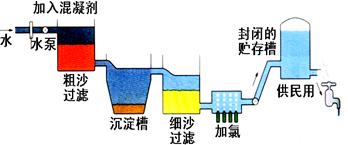
(1)混凝剂除去悬浮物质的过程(填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成沉淀。
(2)实验室过滤操作所用到的玻璃仪器是。
(3)我们有时感觉自来水“有漂白粉气味”是因为使用了氯气消毒,请写出有关的化学反应方程式。
下列物质中,可以作为氯气的代用品。(填写序号)
①臭氧②NH3(液) ③K2FeO4④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有离子交换树脂和离子交换树脂的离子交换柱。(填“阴”或“阳”)
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
求水中的溶解氧量(以mg·g-1为单位)