黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。
(1)该过程中能循环利用的物质为 。
(2)在该过程中,使用膜反应器及时分离出HI分解产生的H2,目的是 (用平衡移动的原理解释)。
(3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。已知浓硫酸的沸点为338℃,加热时酒灯火焰的温度为400℃~500℃。
①甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,请解释生成该白色沉淀的可能原因 (用离子方程式表示)。
②乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检查)。
a.打开弹簧夹通入N2,一段时间后关闭弹簧夹;b.滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。操作a的目的是 ,装置B中的剂是 。
③丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,产生不溶于盐酸的白色沉淀,丙同学滴加的试剂可能是 (填字母编号)。
a.NaOH溶液 b.H2O2溶液 c.新制氯水 d.酸性KmnO4溶液
④装置D中与导管连接的是硬质玻璃管,则装置D的作用是 。
蛋壳的主要成分是CaCO3,其次是SiO2、MgCO3及色素等杂质,测定蛋壳中钙的含量时常涉及如图操作步骤,其中最后滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。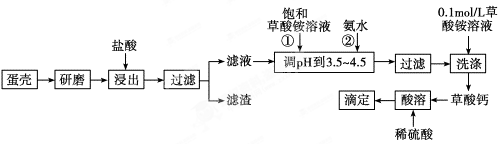
资料支持:①草酸的电离方程式为H2C2O4 H++HC2O4-;
H++HC2O4-;
②滴定过程的反应为H2C2O4+MnO2+H+―→Mn2++CO2↑+H2O(未配平);
③Ksp(CaC2O4)=2.5×10-9,Ksp(MgC2O4)=8.6×10-5
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________;
(3)实验中通常用0.1 mol/草酸铵溶液洗涤沉淀。若实验时用水洗涤沉淀,且每次洗涤时消耗草酸铵溶液和水的体积相同,则每次洗涤时用草酸铵溶液洗涤与用水洗涤损失的质量之比为________;
(4)达到滴定终点的特征为________________;
(5)若考虑MgCO3的存在,则此法求得的钙含量略__________实际值(填>、=、<)
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用_______式滴定管盛装c mol/L盐酸标准液。下图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中,此时滴定管中液体的体积__________mL。 
②下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0—8.0 |
3.1—4.4 |
4.4—6.2 |
8.2—10.0 |
该实验应选用________作指示剂;
③有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
V |
0.50 |
25.80 |
25.30 |
| 2 |
 V V |
|||
| 3 |
V |
6.00 |
31.35 |
25.35 |
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
c = ______________________________。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
A.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________;
B.读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________;
C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
D.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果__________。
某化学兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。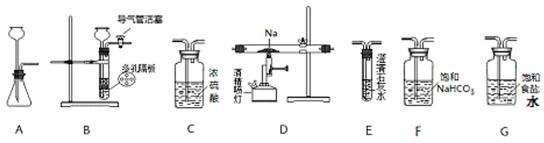
请回答下列问题:
(1)选择必要的仪器,按___________________________顺序连接好装置(填装置序号)。
(2)检验装置B气密性的方法:__________________________________。
(3)实验时,在点燃酒精喷灯前必须进行的操作是______________________,待装置E中出现_____________现象时,再点燃酒精喷灯,以上操作的目的是___________________。
(4)加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成。两种产物中有一种是重要的化工原料,在玻璃工业中用量很大。则钠与二氧化碳反应的化学方程式是______________。
(5)上述实验生成的黑色物质与浓硫酸在一定条件下反应会生成一种大气污染物,可利用酸性KMnO4溶液来测定该气体在空气中的含量,反应的离子方程式__________________;判定反应是否需要指示剂(如果需要,选择何种指示剂,请描述现象。如果不需要,请说明理由。)___________________________________________。
氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,用KMnO4、KClO3氧化浓盐酸可快速制取氯气.根据上述反应原理,有人提出能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢.某课外小组在实验室进行了探索性实验,设计了如图装置: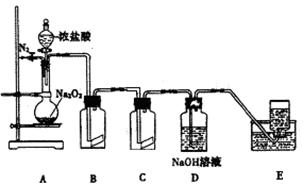
操作步骤及现在如下:
①组装好装置,检查装置的气密性,加入药品.
②缓慢通入一定量的N2后,将装置E连接好(导管未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体.
③一段时间后,将导管末端伸入集气瓶中收集气体.装置E中收集到能使带火星的木条复燃的无色气体.
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色.
回答下列问题:
(1)写出KClO3氧化浓盐酸制取Cl2的离子方程式
(2)装置B中湿润的红色布条褪色,说明A中有 (填化学式)生成,装置C中为湿润的KI-淀粉试纸,能否仅通过试纸变蓝证明上述结论,请用离子方程式说明原因
(3)装置D的作用是
(4)写出生成O2的可能的反应方程式
(5)实验证明,Na2O2甚至能与干燥的HCl反应生成氯气,写出反应的化学方程式
综合上述实验,请分析实验室(填”能”或”否”)利用Na2O2与浓盐酸反应制备纯净的Cl2,理由是
(13分)下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。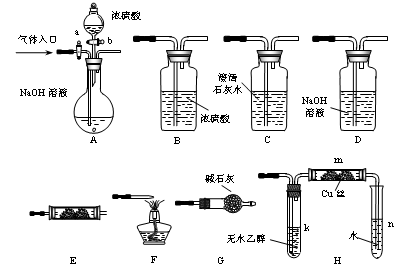
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为___________ (填代号)。能验证CO氧化产物的现象是___________________________________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应________,活塞b应_________,需要加热的两处仪器装置有___________(填代号),m中反应的化学方程式为____________________________________。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有: __________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有___________性。