将V1mL1.0mol·L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是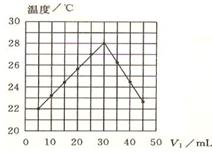
| A.做该实验时环境温度为22℃ |
| B.该实验表明化学能可转化为热能 |
| C.NaOH溶液的物质的量浓度约为1.0mol/L |
| D.该实验表明有水生成的反应都是放热反应 |
向紫色Cr2(SO4)3溶液中,加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色) +3OH- 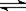 Cr(OH)3(蓝灰色)
Cr(OH)3(蓝灰色) 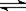 CrO2- (绿色)+H+ + H2O,将上述悬浊液等分两份a和b。向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为
CrO2- (绿色)+H+ + H2O,将上述悬浊液等分两份a和b。向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为
| A |
B |
C |
D |
|
| a试管 |
紫色 |
蓝灰色 |
蓝色 |
绿色 |
| b试管 |
绿色 |
绿色 |
紫色 |
紫色 |
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)+ H2O(g) CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
| A.减小压强 | B.增大压强 | C.分离除乙醇 | D.升高温度 |
下列热化学方程式书写正确的是
| A.C(s) + O2(g) ="=" CO2(g) ;△H=" +393.5" kJ/mol |
| B.H2(g) + 1/2O2(g) ="=" H2O(l);△H =-285.8 kJ/mol |
| C.2SO2 + O2 ="=" 2SO3;△H =-196.6 kJ/mol |
| D.2H2(g) + O2(g) ="=" 2H2O(l) ;△H =-571.6 kJ |
一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)  2B(g)+C (g),下列能说明反应已达平衡状态的是
2B(g)+C (g),下列能说明反应已达平衡状态的是
A.混合气体的密度保持不变 B.容器内B、C的浓度之比为2∶1
C.B的生成速率等于C的消耗速率D.气体的体积分数保持不变
已知448℃时反应H2(g)+I2(g) 2HI(g)的平衡常数是49,则
2HI(g)的平衡常数是49,则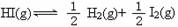 ,在该温度下的平衡常数是
,在该温度下的平衡常数是
A.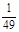 |
B.2401 | C.7 | D.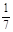 |