0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
| A.5 : 2 | B.3 : 1 | C.15 : 2 | D.1 : 3 |
下列说法中正确的是()
A. 与 与 均可以水解,故NH4HCO 均可以水解,故NH4HCO 3是弱电解质 3是弱电解质 |
B.25℃时,1LpH=3的盐酸与l LpH=11的氨水 能恰好中和 能恰好中和 |
| C.25℃时,用pH试纸测定出某醋酸溶液的pH=3.5 |
D.25℃时,pH=14的溶液中,Na+、 、K+、ClO-可以大量共存 、K+、ClO-可以大量共存 |
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是()
A.Mg2++ +2Ca2++4OH- +2Ca2++4OH- Mg(OH)2↓+2CaCO3↓+2H2O Mg(OH)2↓+2CaCO3↓+2H2O |
B.Cu2++H2S CuS↓+2H+ CuS↓+2H+ |
C.Zn2++S2-+2H2O Zn(OH)2↓+H2S↑ Zn(OH)2↓+H2S↑ |
D.FeS+2H+ Fe2++H2 S↑ Fe2++H2 S↑ |
下列各项叙述中,正确的是()
| A.电子层序数越大,s原子轨道的半径越大,形状发生明显的变化 |
| B.在同一电子层上运动的电子,其自旋方向肯定不同 |
| C.电负性的大小可以作为判断金属性和非金属性强弱的尺度 |
| D.原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
下列溶液一定能大量共存的离子组是()
A.能与铝反应产生H2的溶液: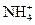 、Na+、Cl-、 、Na+、Cl-、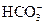 |
| B.含有大量Fe3+的溶液中:Na+、I-、K+、Br- |
C.能使pH试纸变深蓝色的溶液中:Na+、 、S2-、 、S2-、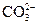 |
D.澄清透明的无色溶液中:ClO-、 、Al3+、 、Al3+、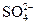 |
下列行为违背“环境友好和可持续发展”战略的是()
| A.我国内蒙的煤田正在进行将煤液化汽化,同时对产品进行综合利用的研究 |
| B.南京某大学的研究所正在进行的以植物秸秆为原料制生物柴油的研究 |
| C.2010年初我国各地大面积的暴雪造成了严重灾害,为了加快因灾导致瘫痪的高速公路的快速恢复,在高速路面大范围的使用融雪剂 |
| D.某化工厂正在进行以“设计绿色化工工艺,提高原子利用率”为目标的产业换代 |