在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为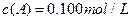 、
、 及
及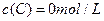 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②____________ ;
③_______________ ;
(2)实验②平衡时B的转化率为________;实验③平衡时C的浓度为__________;
(3)该反应的 _______0,判断其理由是________________________________;
_______0,判断其理由是________________________________;
(4)该反应进行到4.0min时的平均反应速率:
实验②: =_______________________;实验③:
=_______________________;实验③: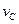 =____________________。
=____________________。
根据下表信息回答以下问题:部分短周期元素的原子半径及主要化合价。
| 元素 |
A |
B |
C |
D |
| 原子半径(nm) |
0.130 |
0.118 |
0.090 |
0.102 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6,-2 |
| 元素 |
E |
F |
G |
H |
| 原子半径(nm) |
0.073 |
0.154 |
0.037 |
0.099 |
| 主要化合价 |
-2 |
+1 |
+1 |
+7,-1 |
(1)E、F、G三元素形成的化合物中化学键类型是______。
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是________。
(3)实验室中制取H单质反应的化学方程式是________。
(4)将A、B两种元素的单质用导线连接浸入NaOH溶液中,发现导线中有电流产生,其负极反应式为________。
.福建有广阔的海岸线,建设海峡西岸经济区,海水的综合利用大有可为。海水中溴含量约为65 mg·L-1,从海水中提取溴的工业流程如下: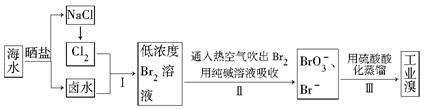
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是______
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性B.还原性 C.挥发性D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:_______________。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇B.四氯化碳 C.烧碱溶液D.苯
.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化。
(1)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为________kJ·mol-1,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1molC2H2(g)的ΔH。
C(石墨)+O2(g)===CO2(g)ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599.2kJ·mol-1,
则由C(石墨)和H2(g)反应生成1molC2H2(g)的ΔH=________kJ·mol-1。
②已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出XkJ热量。已知单质碳的燃烧热为YkJ·mol-1,则1molC与O2反应生成CO的反应热ΔH为________。
.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液法 B 加热分解法 C.结晶法 D.分液法 E 蒸馏法 F 过滤法
(1)________分离饱和食盐水与沙子的混合的。
(2)________从KNO3和NaCl的混合溶液中获得KNO3。
(3)________分离水和汽油的混合物。
(4)________分离四氯化碳(沸点76.75℃)和甲苯(沸点110.6℃)的混合物。
(5)________从碘的水溶液里提取碘。
(6)________从NaCl与NH4HCO3固体混合物中得到NaCl。
2 mol O3和3 mol O2的质量之比________,分子数之比________,同温同压的密度之比为________,含氧原子数之比为________,体积之比为________。