硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: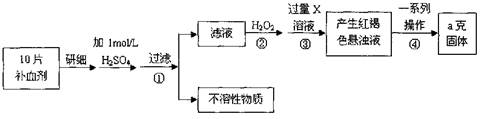
请回答下列问题:
(1))证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硝酸
③滴定到终点时(恰好完全反应)的颜色为 色。
(12分)写出下列反应的热化学方程式。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g)ΔH=-196.46kJ/mol
H2(g)+1/2 O2(g)=H2O(l)ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为。
(2)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
(3)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧热的热化学方程式
磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是,其相应的质量(g)为。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH=。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式:
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=,△H0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为。
A(g)+B(g)的平衡常数的值为。
能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是(填字母)。
a. 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b. 大力开采煤、石油和天然气以满足人们日益增长的能源需求
c. 开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d. 减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。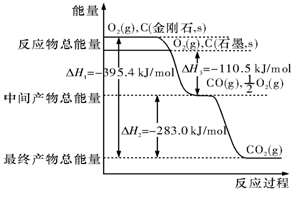
(a)在通常状况下,金刚石和石墨相比较,(填”金刚石”或”石墨”)更稳定,石墨的燃烧热为。
(b)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ ▪mol-1、497 kJ ▪mol-1。
N2 (g)+ O2 (g)="==" 2 NO (g)H="+180.0" kJ ▪mol-1。
NO分子中化学键的键能为kJ ▪mol-1。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:。
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
COCl2的分解反应为COCl2(g)  Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未画出):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未画出):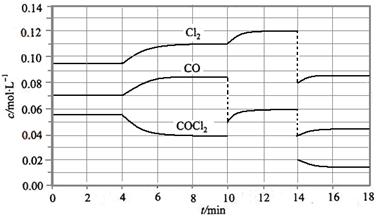
(1) 计算反应在第8 min 时的平衡常数K = ;
(2) 比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2)T(8)(填“<”、“>”或“=”);
(3) 若12 min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = mol·l-1;
(4) 比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
(5)比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6)v(12~13) (填“<”、“>”或“=”),原因是。