硫通常是一种淡黄色晶体,它的蒸气有橙色、无色、红棕色三种,它们都是硫的单质,但是每个分子中硫原子的个数不同,可用SX表示,对三种蒸气测定的结果是:
(1)橙色蒸气的密度折算成标准状况后是11.34克/升,它的分子式为:
(2)红棕色蒸气的质量是相同状况下同体积空气的6.62倍,则它的分子式为:
(3)无色蒸气的密度是同状况下氢气密度的64倍,则它的分子式为: 。
A、B、C属于周期表前4周期的元素,它们的原子序数依次增大。A、B属于同一周期,A、C是生活中常见的金属元素。C的原子序数是A的2倍,B的单质常温下为黄色粉末。
(1)C在周期表中位于周期族。
(2)在加热条件下B单质与C单质反应的化学方程式是。
(3)A的氧化物是某矿物的主要成分,由该矿物提取A元素的第一步是用NaOH溶液处理矿物,使A元素变为可溶性盐,该反应的离子方程式是。
(4)B与C形成的化合物CB2,在有水存在的条件下用氧气氧化该化合物,得到强酸性溶液,低温下从该强酸性溶液中还可结晶出浅绿色的C的低价盐,该氧化还原反应的化学方程式是。
A、B、C、D为四种由短周期元素形成的化合物,它们的焰色反应均为黄色,并有下列转化关系。A中既含有离子键又含有非极性共价键,D含四种元素。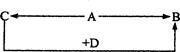
(1)A的电子式是。
(2)把1 molCO2通入含2 molC的溶液后,溶液中各离子浓度由大到小的顺序是。
(3)1 molA与2 molD固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体是(用化学式表示)。
已知在一定条件下3分子乙炔可发生加成反应生成苯: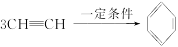
试预测下列物质3分子加成后的产物。
(1)3H—C≡ (2)3
(2)3

实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
③在50 ℃—60 ℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。完成下列空白:
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是__________________________。
(2)步骤③中,为了使反应在50 ℃—60 ℃下进行,常用的方法是______________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是_______________________。
(4)步骤④中粗产品用5% NaOH溶液洗涤的目的是______________________。
取0.1 mol苯的同系物完全燃烧后,生成的气体通过浓硫酸,浓硫酸增重10.8 g,再通过氢氧化钾溶液后,气体减轻39.6 g。该苯的同系物在苯环上的一氯代物、二氯代物、三氯代物分别只有一种。根据上述条件,推断它的分子式是___________,结构简式是___________,名称是___________。