设阿伏加德罗常数为NA,则下列说法正确的是( ▲ )
| A.常温常压下,11.2L辛烷中含有的碳原子数为4NA |
| B.在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
| C.常温下,1L 0.1mol/L Al2(SO4)3溶液中含Al3+数为0.2NA |
| D.常温下,2.7g铝与足量盐酸反应,失去电子数为0.3NA |
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c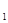 、c
、c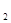 、c
、c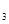 (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
A.c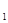 :c :c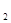 =1:2 =1:2 |
| B.平衡时,Y和Z的生成速率之比为2:3 |
| C.X、Y的转化率相等 |
D.c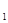 的取值范围为0.04 mol/L<c 的取值范围为0.04 mol/L<c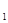 <0.14 mol/L <0.14 mol/L |
在N2 (g)+ 3H2(g) 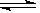 2 NH3 (g)的平衡体系中,其他条件不变,增加氮气的浓度,下列判断正确的是
2 NH3 (g)的平衡体系中,其他条件不变,增加氮气的浓度,下列判断正确的是
| A.氮气的转化率增大 |
| B.氢气的转化率增大 |
| C.氨气在平衡混合气体中的百分含量一定增大 |
| D.氨气的分解速率大于氨气的生成速率 |
已知:2Zn(s)+O2(g)=2ZnO(s)ΔH= -701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s)ΔH= -181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的ΔH为
| A.+519.4kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4kJ·mol-1 |
在一个定容密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
| A.0.1 mol·L-1·min-1 | B.0.3 mol·L-1·min-1 |
| C.0.2 mol·L-1·min-1 | D.0.6 mol·L-1·min-1 |
下列关于铜电极的叙述不正确的是
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼铜时粗铜作阳极 |
| C.在镀件上镀铜时可用铜作阳极 |
| D.电解稀硫酸溶液制H2、O2时铜做阳极 |