普通锌锰干电池的简图(如右下图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽。在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:
Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O
关于锌锰干电池的下列说法中正确的是( ▲ ) 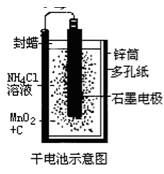
| A.当该电池电压逐渐下降后,利用电解原理能重新充电复原 |
| B.电池正极的电极反应式为: 2MnO2+2NH4++2e- ="=" Mn2O3+2NH3+H2O |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5g |
相同温度下,相同物质的量浓度的四种溶液:①CH3COONa,②NaHSO4,③NaCl,④ 。按pH值由大到小顺序排列正确的是 ( )
。按pH值由大到小顺序排列正确的是 ( )
| A.④①③② | B.①④③② | C.①②③④ | D.④③②① |
下列说法中错误的是 ( )
| A.在Na2S溶液中滴入酚酞试液,呈红色 |
| B.升高温度能使FeCl3溶液中的H+浓度增大 |
| C.一切钾盐、钠盐、硝酸盐都不发生水解 |
| D.醋酸盐溶于水能发生水解 |
物质的量浓度相同的下列各溶液,由水电离出的氢氧根浓度由大到小的顺序()
①NaHSO4② NaHCO3③ Na2CO3④ Na2SO4
| A.④③②① | B.①②③④ | C.③②④① | D.③④②① |
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的情况下加入一种试剂,过滤后,在加入适量的盐酸,这种试剂是()
| A.NH3•H2O | B.NaOH | C.Na2CO3 | D.MgCO3 |
有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是
| A.在三种酸HX、HY、HZ中以HX酸性相对最强 |
| B.HX、HY、HZ三者均为弱酸 |
| C.在X-、Y-、Z-三者中,以Z-最易发生水解 |
| D.中和1molHY酸,需要的NaOH稍小于1mol |