图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。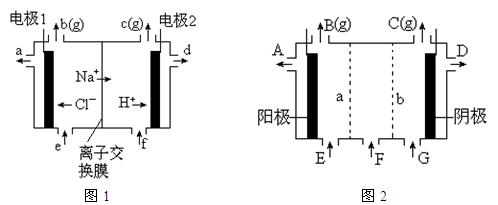
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO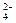 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。
(1)火箭常用N2H4作燃料,N2O4作氧化剂。已知:
N2(g) + 2O2(g)=2NO2(g)△H = +67.7 kJ·mol-1
N2H4(g) + O2(g)=N2(g) + 2H2O(g)△H =-534.0 kJ·mol-1
NO2(g)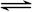 1/2N2O4(g)△H =-26.35 kJ·mol-1
1/2N2O4(g)△H =-26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:。
(2)联氨——空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。该电池放电时,正极的电极反应式为 。
(3)在300℃时,改变起始反应物中氢气的物质的量对反应N2(g) + 3H2(g) 2NH3(g)△H<0的影响如图所示。
2NH3(g)△H<0的影响如图所示。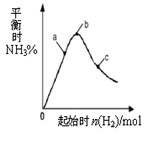
①请在图中画出400℃时对应的图像。
②在a、b、c三点中,H2 的转化率最高的是 (填字母)。
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 NO+NO2+Na2CO3=2NaNO2+CO2
若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
PTT是近几年来迅速发展起来的新型热塑性聚酯材料,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为: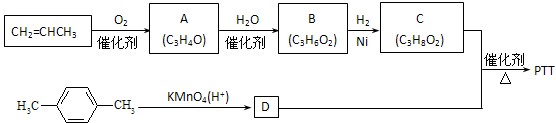
其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A中所含官能团的名称为,B的结构简式为。
(2)由物质C与D反应生成PTT的化学方程式为,反应类型为。
(3)分子式为C4H6O、与A互为同系物的同分异构体有种。
(4)请补充完整下列以CH2=CHCH3为主要原料(无机试剂任用)制备CH3CH(OH)COOH
的合成路线流程图(须注明反应条件)。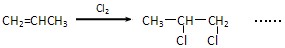
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。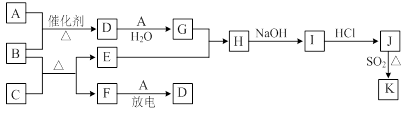
已知: A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为;F的电子式为。
(2)A与B生成D的反应在工业上是生产的反应原理之一。
(3)E与G的稀溶液反应的离子方程式为。
(4)B和C反应的化学方程式为。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子
方程式。
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:2SO2(g)+O2(g)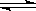 2SO3(g)△H=-196 kJ·mol-1。
2SO3(g)△H=-196 kJ·mol-1。
(1)该反应的平衡常数表达式为K=;某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是(填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极反应式。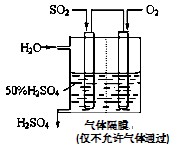
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: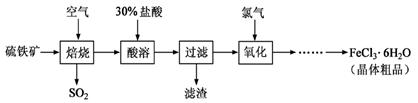
回答下列问题:
(1)过量的SO2与NaOH溶液反应的离子方程式为。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、。
(3)通氯气氧化时,发生的主要反应的离子方程式为;该过程产生的
尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)。