写出下列反应的化学反应方程式,并判断其反应类型。
①乙醇的催化氧化: ,属于 反应;
②由苯制取溴苯: ,属于 反应;
③由苯制取环己烷: ,属于 反应;
④由乙烯制取聚乙烯: ,属于 反应;
莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种同分异构体。A的结构简式如下:
(1)A的分子式是。
(2)A中含氧官能团的名称是________________________。
(3)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是。
(4)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是。
(5)17.4克A与足量碳酸氢钠溶液反应,生成二氧化碳的体积(标准状况)。
(6)A在浓硫酸作用下加热可与1molCH3CH2CH2OH发生反应,写出反应的化学方程式:,其反应类型。
在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
| 时间(s) 浓度 (mol·L—1) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) |
0.100 |
C1 |
0.050 |
C3 |
a |
b |
| C(NO2) |
0.000 |
0.060 |
C2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为,达到平衡时,四氧化二氮的转化率为,表中C2C3,ab(填“>”、“<”或“=”)
(2)20s时四氧化二氮的浓度C1=mol·L—1,在0~20s时间段内,四氧化二氮的平均反应速率为
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
||||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
(1)①和②形成的最简单有机化合物分子的结构式为_____________。
(2)下列事实能证明②的非金属性比⑥强的是
A.Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(3)写出①、③、④三种元素组成化合物的电子式___________。
(4)③、④、⑤所形成的简单离子半径由大到小的顺序:_______。
(5)①、②、⑦三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有种。
(6)最近科学家制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示).电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.已知该电池的负极反应为:
C4H10+13O2--26e-===4CO2+5H2O
则该电池的正极反应为__________________,电池工作时,电池中O2-向________极移动.
(每空2分)(共6分) Knoevenagel反应是有机合成中的一种常见反应:
化合物Ⅱ可以由以下合成线路获得: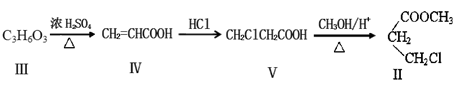
(1)已知 1 mo1化合物Ⅲ可以与2 mo1Na发生反应,且化合物Ⅲ的核磁共振氢谱有四组峰,峰面积之比为1:1:2:2,则Ⅲ的结构简式。
(2)下列关于化合物Ⅰ~Ⅳ的说法正确的是_______ (填字母)。(双选)
| A.1mol化合物Ⅰ与H2发生加成,最多需要H2为4mol |
| B.化合物Ⅱ能与NaOH水溶液发生水解反应 |
| C.化合物Ⅲ一定含有碳碳双键、羟基和羧基官能团 |
| D.化合物Ⅳ在一定条件下能发生加聚反应和酯化反应 |
(3)化合物Ⅴ 与NaOH醇溶液加热下反应的化学方程式为。
有机物A可以通过不同的反应得到B和C:
(1)A的分子式为,C的含氧官能团名称为。
(2)A制取B的有机反应类型为;A制取C的化学方程式为:。
(3)A发生消去反应后产物的结构简式为,A分子中一定共面的碳原子有个。